
Wetenschap
Waarom reageren groepen 1 en 2 in het periodiek systeem gemakkelijk?
1. Lage ionisatie-energie :
Deze elementen hebben een lage ionisatie-energie. Alkalimetalen (groep 1) hebben één valentie-elektron (ns1), terwijl aardalkalimetalen (groep 2) twee valentie-elektronen (ns2) hebben. Het is gemakkelijker voor hen om deze valentie-elektronen te verliezen, wat resulteert in de vorming van positief geladen ionen (kationen).
2. Vorming van elektropositieve ionen:
Wanneer elementen uit groep 1 en groep 2 hun valentie-elektronen verliezen, krijgen ze een positieve lading en worden ze elektropositieve ionen. Elektropositieve ionen worden sterk aangetrokken door elektronegatieve ionen, wat leidt tot de vorming van verschillende chemische verbindingen.
3. Hoge reactiviteit met niet-metalen:
Groep 1- en groep 2-elementen reageren krachtig met niet-metalen om hun valentieschillen te voltooien en elektronische stabiliteit te bereiken. Natrium (groep 1) reageert bijvoorbeeld met chloorgas (een niet-metaal) om natriumchloride (NaCl) te vormen, een ionische verbinding.
4. Reactiviteit en periodieke trends:
Als je binnen groep 1 en 2 naar beneden gaat, neemt de reactiviteit van de elementen toe. Dit komt omdat de atomaire grootte toeneemt en de valentie-elektronen zich verder van de positief geladen kern bevinden. Als gevolg hiervan worden de elektronen losser vastgehouden en gemakkelijker te verwijderen, wat leidt tot een verhoogde reactiviteit.
5. Vorming van stabiele oxiden en hydroxiden:
Groep 1- en groep 2-elementen reageren met zuurstof en water om stabiele oxiden en hydroxiden te vormen. Alkalimetalen vormen basische oxiden (bijvoorbeeld Na2O) en hydroxiden (bijvoorbeeld NaOH), terwijl aardalkalimetalen stabielere oxiden (bijvoorbeeld CaO) en hydroxiden (bijvoorbeeld Ca(OH)2) vormen.
6. Hoge smelt- en kookpunten:
De sterke elektrostatische aantrekkingskracht tussen positief geladen metaalionen en negatief geladen niet-metaalionen resulteert in hoge smelt- en kookpunten voor hun verbindingen. Dit kenmerk is vooral uitgesproken bij verbindingen uit groep 1 en groep 2.
Samenvattend kan de sterke neiging van de elementen uit groep 1 en 2 om te reageren en verbindingen te vormen worden toegeschreven aan hun lage ionisatie-energieën, de vorming van elektropositieve ionen, hun reactiviteit met niet-metalen en de stabiliteit van hun oxiden en hydroxiden. Deze eigenschappen spelen een cruciale rol in hun brede scala aan toepassingen, waaronder gebruik als reductiemiddelen, als bron van metaalionen in biologische processen en bij de productie van verschillende industriële chemicaliën.
 Onderzoekers zeggen dat natuurherstel in alle sectoren moet worden geïntegreerd om de curve van het verlies aan biodiversiteit te buigen
Onderzoekers zeggen dat natuurherstel in alle sectoren moet worden geïntegreerd om de curve van het verlies aan biodiversiteit te buigen  Klimaatwetenschappers creëren model voor wereldwijde bosgroei tot 2060
Klimaatwetenschappers creëren model voor wereldwijde bosgroei tot 2060 Poll:Rampen beïnvloeden denken over klimaatverandering
Poll:Rampen beïnvloeden denken over klimaatverandering Temperatuurpiek:aardse banden registreren hoge hitte Mei-lezing
Temperatuurpiek:aardse banden registreren hoge hitte Mei-lezing Een biljoen bomen niet genoeg om de klimaatcrisis op te lossen, critici zeggen:
Een biljoen bomen niet genoeg om de klimaatcrisis op te lossen, critici zeggen:
Hoofdlijnen
- Huidbiologie verheldert hoe stamcellen werken
- Hoe huidcellen zichzelf beschermen tegen stress
- Hoe ziet de toekomst van plastic eruit?
- Waar wordt messenger-RNA gehecht tijdens de eiwitconstructie?
- Mysterieus cirkelgedrag van reuzenhaaien uitgelegd
- Wat is de enige manier waarop een recessieve eigenschap tot uiting komt?
- Wat zijn de meest voorkomende ziekten van orgaansystemen?
- Hommels kunnen volgens de Californische instandhoudingswet als vissen worden geclassificeerd, zegt de rechtbank
- IJsberen die rendieren eten:normaal gedrag of gevolg van klimaatverandering?
- Hoe een biofysische simulatiemethode het ontdekken van medicijndoelen kan versnellen?
- Onderzoekers demonstreren een fundamenteel nieuwe benadering van echografie

- Onderzoekers ontwikkelen synthetische T-cellen die de vorm nabootsen, functie van menselijke versie

- Nieuw additief biedt brandbeveiliging voor hout

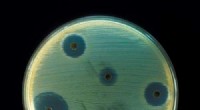
- Octapeptin:Vergeten antibioticum biedt hoop tegen de ergste superbacteriën
 Nieuwe transistors:een alternatief voor silicium en beter dan grafeen
Nieuwe transistors:een alternatief voor silicium en beter dan grafeen Een onwaarschijnlijk gebruik voor diamanten
Een onwaarschijnlijk gebruik voor diamanten Quantum snelheidslimieten zijn niet echt kwantum
Quantum snelheidslimieten zijn niet echt kwantum Nanostructuren gemaakt van DNA
Nanostructuren gemaakt van DNA Zijn 1-pentanol en 2-pentanol dezelfde oplosbaarheid in water?
Zijn 1-pentanol en 2-pentanol dezelfde oplosbaarheid in water?  Toekomstige weersvoorspelling - het zit allemaal in de MRI van wolken
Toekomstige weersvoorspelling - het zit allemaal in de MRI van wolken De vergeten wetenschapper die de weg vrijmaakte voor de ontdekking van de DNA-structuur
De vergeten wetenschapper die de weg vrijmaakte voor de ontdekking van de DNA-structuur Om radioactief neptunium en plutonium te bestuderen, ontwikkelen onderzoekers een nieuwe chemie
Om radioactief neptunium en plutonium te bestuderen, ontwikkelen onderzoekers een nieuwe chemie
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

