
Wetenschap
Heeft verschillende vloeistoffen invloed op het tijdstip van oplossen?
factoren die de oplossing van de oplossing beïnvloeden:
* polariteit:
* "zoals oplost zoals" is een belangrijk principe. Polaire oplosmiddelen (zoals water) lossen polaire opgeloste stoffen (zoals suiker) goed op. Niet-polaire oplosmiddelen (zoals olie) lossen niet-polaire opgeloste stoffen (zoals vetten) goed op. Als het oplosmiddel en de opgeloste stof verschillende polariteiten hebben, zal oplossen traag zijn of helemaal niet gebeuren.
* Temperatuur:
* Hogere temperaturen verhogen de kinetische energie van moleculen, waardoor ze sneller bewegen en vaker botsen. Dit versnelt oplossen.
* agitatie:
* Roeren of schudden van een oplossing helpt vers oplosmiddel om contact op te nemen met de opgeloste stof, waardoor de oplossingsnelheid wordt verhoogd.
* oppervlakte:
* Het breken van een vaste stof in kleinere stukken verhoogt het oppervlak, waardoor meer van de opgeloste stof wordt blootgesteld aan het oplosmiddel en het versnellen van oplossen.
* concentratie:
* Een hogere concentratie opgeloste opgeloste stof maakt het moeilijker voor meer opgeloste stof om op te lossen.
Voorbeelden:
* Suiker in water: Lost snel op omdat beide polair zijn.
* Suiker in olie: Lost zeer langzaam op (of helemaal niet) omdat ze verschillende polariteiten hebben.
* zout in heet water: Lost veel sneller op dan zout in koud water door de verhoogde kinetische energie.
Kortom: De aard van de vloeistof (de polariteit, de temperatuur en andere factoren) speelt een cruciale rol in hoe snel een vaste stof oplost.
 DNAzymes zouden beter kunnen presteren dan eiwitenzymen voor genetische manipulatie
DNAzymes zouden beter kunnen presteren dan eiwitenzymen voor genetische manipulatie Algoritme voorspelt de samenstelling van nieuwe materialen
Algoritme voorspelt de samenstelling van nieuwe materialen hoe zwaarder, hoe beter - superieure stabiliteit in isotoop-gefunctionaliseerde perovskieten
hoe zwaarder, hoe beter - superieure stabiliteit in isotoop-gefunctionaliseerde perovskieten Wat zijn de wetenschappelijke principes achter gitaar?
Wat zijn de wetenschappelijke principes achter gitaar?  Kunnen mengsels veel gemakkelijker worden gescheiden dan verbindingen?
Kunnen mengsels veel gemakkelijker worden gescheiden dan verbindingen?
 Indringende vraag:Kunnen mensen het weer beheersen?
Indringende vraag:Kunnen mensen het weer beheersen?  Emissies van fossiele brandstoffen volgen met koolstof-14
Emissies van fossiele brandstoffen volgen met koolstof-14 Wat is een derecho? Een atmosferische wetenschapper legt deze zeldzame maar gevaarlijke stormsystemen uit
Wat is een derecho? Een atmosferische wetenschapper legt deze zeldzame maar gevaarlijke stormsystemen uit  De lente smelt een pad door de bevroren Finse archipel
De lente smelt een pad door de bevroren Finse archipel Wat gebeurt er als een bijenkoningin sterft?
Wat gebeurt er als een bijenkoningin sterft?
Hoofdlijnen
- Welke voedingsstoffen verlaten een plantencel?
- Heb je een zoetekauw? Geef je lever de schuld
- Twee individuen die heterozygoot zijn voor één eigenschap hebben kinderen. Wat is de verwachte fenotypische verhouding van mogelijke nakomelingen?
- Nieuwe inzichten over hoe de vogelgriep de soortbarrière overschrijdt
- Worden leiders geboren of gemaakt? Nieuw onderzoek laat zien hoe leiderschap zich ontwikkelt
- Waarom is stikstof nodig door planten en dieren?
- Xist- en lapjeskatten:hoe extra genen op X-chromosomen worden uitgeschakeld
- Wat is de juiste uitspraak over bryofyten? A hebben gespecialiseerde weefsels die water geleiden. B. Opgenomen door osmose. C. Zijn niet erg afhankelijk van de D-plantengroep bestaande uit algen en mossen.
- Welke technologie was nodig voordat de celtheorie zich ontwikkelde?
- Gemodificeerde peptiden kunnen de groei en ontwikkeling van planten stimuleren
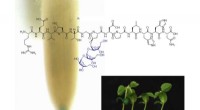
- Belangrijke rol van singletzuurstof in synergetisch antimicrobieel mechanisme

- Populair hulpmiddel voor het ontdekken van medicijnen is nu 10 keer sneller geworden

- De eiwitten die de biosynthese van formicamycine behouden

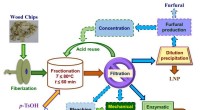
- Delignificatie van houtmonsters met p-tolueensulfonzuur als recyclebare hydrotroop
 Zwarte en Indiaanse studenten onevenredig gedisciplineerd, studie vondsten
Zwarte en Indiaanse studenten onevenredig gedisciplineerd, studie vondsten Hoe bouw ik een 3D Iron Atom?
Hoe bouw ik een 3D Iron Atom?  Hoe schat je vierkante decimeters?
Hoe schat je vierkante decimeters?  Afbeelding:opengewerkte weergave van nanodeeltjes in een neurale cel
Afbeelding:opengewerkte weergave van nanodeeltjes in een neurale cel Koraalstudie traceert overtollige stikstof naar de afvalwaterzuiveringsinstallatie van Maui
Koraalstudie traceert overtollige stikstof naar de afvalwaterzuiveringsinstallatie van Maui Edelmetaalvlekken kunnen een katalysator zijn voor betere kankertherapieën
Edelmetaalvlekken kunnen een katalysator zijn voor betere kankertherapieën Wetgevers vragen 4 grote technologiebedrijven om documenten in onderzoek
Wetgevers vragen 4 grote technologiebedrijven om documenten in onderzoek NASA-satellieten kijken in een scheve orkaan Maria
NASA-satellieten kijken in een scheve orkaan Maria
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

