
Wetenschap
Wat zijn enkele snelle chemische reacties?
Extreem snelle reacties (picoseconden voor nanoseconden):
* explosies: Explosies omvatten extreem snelle exotherme reacties die in korte tijd een grote hoeveelheid energie afgeven, waardoor een schokgolf wordt gegenereerd.
* Detonatie van explosieven: TNT, dynamiet en andere explosieven ondergaan snelle ontledingsreacties die in een fractie van een seconde een groot volume gas produceren.
* verbranding: De snelle reactie tussen een brandstof en een oxidatiemiddel (typisch zuurstof) om warmte en licht te produceren.
* brandend brandstoffen: Hout, benzine en aardgas verbranden snel in aanwezigheid van zuurstof, waardoor energie wordt vrijgelaten.
* Fotchemische reacties: Reacties geïnitieerd door lichtabsorptie, vaak voorkomend in de femtoseconde (10^-15 seconden) op picoseconde (10^-12 seconden) tijdschema.
* fotosynthese: Het proces waardoor planten zonlicht omzetten in chemische energie.
* visie: De absorptie van licht door rhodopsine in het oog initieert een reeks chemische reacties die leiden tot zicht.
snelle reacties (microseconden tot milliseconden):
* Neutralisatiereacties: Reacties tussen zuren en basen, die vaak snel in oplossing gaan.
* titraties: Gebruikt in de chemie om de concentratie van een oplossing te bepalen.
* Enzym-gekatalyseerde reacties: Reacties gekatalyseerd door enzymen, die de snelheid van een reactie met vele orden van grootte kunnen verhogen.
* Digestie: Enzymen breken voedselmoleculen af in kleinere componenten.
* Elektrochemische reacties: Reacties die op het gebied van een elektrode en een elektrolyt optreden.
* batterijen: Elektrochemische reacties in batterijen zetten chemische energie om in elektrische energie.
factoren die de reactiesnelheid beïnvloeden:
* Temperatuur: Hogere temperaturen verhogen over het algemeen de reactiesnelheden.
* concentratie: Hogere concentraties reactanten verhogen de kans op botsingen, wat leidt tot snellere reacties.
* oppervlakte: Grotere oppervlakken zorgen voor meer contact tussen reactanten, toenemende reactiesnelheid.
* katalysator: Een katalysator versnelt een reactie zonder in het proces te worden geconsumeerd.
Opmerking: Dit is geen uitputtende lijst en de snelheid van een reactie kan variëren afhankelijk van specifieke omstandigheden.
 Als een zuur reageert met een stof, wat ontstaat er dan altijd als een van de producten?
Als een zuur reageert met een stof, wat ontstaat er dan altijd als een van de producten?  Ontdekking van periodieke tabellen voor moleculen
Ontdekking van periodieke tabellen voor moleculen Chemici vergroten het nut van boor:voorkomen dat verbindingen worden afgebroken, kan scheikundigen helpen bij het ontwerpen van nieuwe medicijnen
Chemici vergroten het nut van boor:voorkomen dat verbindingen worden afgebroken, kan scheikundigen helpen bij het ontwerpen van nieuwe medicijnen Wat is het doel van ringen rond een MC-312-corrosieventanker?
Wat is het doel van ringen rond een MC-312-corrosieventanker?  Nieuwe sonde voor de geheimen van complexe interfaces
Nieuwe sonde voor de geheimen van complexe interfaces
 De beste locatie voor Bat Huizen
De beste locatie voor Bat Huizen  Op dronebeelden is te zien dat de Groenlandse ijskap onstabieler wordt naarmate hij breekt
Op dronebeelden is te zien dat de Groenlandse ijskap onstabieler wordt naarmate hij breekt Kan een kunstmatig koraalrif de mariene biodiversiteit beschermen tegen klimaatveranderingen?
Kan een kunstmatig koraalrif de mariene biodiversiteit beschermen tegen klimaatveranderingen? Welk deel van de plant kan extra voedsel opslaan als suiker of zetmeel?
Welk deel van de plant kan extra voedsel opslaan als suiker of zetmeel?  Grote voordelen van experimentele stroomgebieden
Grote voordelen van experimentele stroomgebieden
Hoofdlijnen
- Wat dieren ons kunnen vertellen over slapen
- Parasitaire gewoonte stimuleert structurele variatie in het plastidegenoom en genverlies bij Cuscuta-soorten
- Welke wetenschapper ontdekte dat hitte ziektekiemen doodt?
- Hoe maak je een 3D-tandmodel voor een schoolproject
- Relatie tussen celstructuur en functie
- Verschillende soorten cellulaire communicatie
- Wat is een gecontroleerde experimentele groep in experiment en waarom het belangrijk is?
- Processen die ATP als energiebron gebruiken
- Verbetering van de kwaliteitsanalyse van zoete aardappel met hyperspectrale beeldvorming en AI
- Onderzoekers karakteriseren moleculaire scharen voor plastic afval
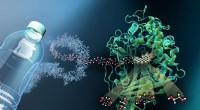
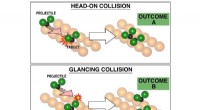
- Chemici bevorderen het vermogen om chemische reacties te beheersen
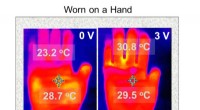
- Elektrisch verwarmd textiel nu mogelijk
- Lasers gebruiken om moleculaire mysteries in onze atmosfeer te visualiseren

- Op ijzer gebaseerde katalysatoren ontdekt in door licht aangedreven kooldioxidehydrogenering

 Kunstspieren vertonen meer flex
Kunstspieren vertonen meer flex Praten over seks is ongemakkelijk, dus hoe kunnen tieners gewoon om toestemming vragen?
Praten over seks is ongemakkelijk, dus hoe kunnen tieners gewoon om toestemming vragen? Hoe Nirvana werkt
Hoe Nirvana werkt  Beperkingen van modellen in Science
Beperkingen van modellen in Science Waarom hebben wetenschappers verschillende opvattingen over het classificeren van levende wezens?
Waarom hebben wetenschappers verschillende opvattingen over het classificeren van levende wezens?  Hoe voltooi je de dierenriempuzzelsleutel in aqworlds?
Hoe voltooi je de dierenriempuzzelsleutel in aqworlds?  Xenofobie sterk verbonden met Brexit, ongeacht de leeftijd van de kiezers, geslacht of opleiding
Xenofobie sterk verbonden met Brexit, ongeacht de leeftijd van de kiezers, geslacht of opleiding Wat gebeurt er met de afvoer in het diagram?
Wat gebeurt er met de afvoer in het diagram?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

