
Wetenschap
Hoe beïnvloedt de temperatuur de reactiesnelheid?
1. Moleculaire beweging en botsingen:
* hogere temperatuur, meer botsingen: Toenemende temperatuur zorgt ervoor dat moleculen sneller en met meer energie bewegen. Dit leidt tot frequentere en krachtige botsingen tussen reactantmoleculen.
* Verhoogde botsingsenergie: De verhoogde kinetische energie van moleculen bij hogere temperaturen betekent ook dat botsingen eerder voldoende energie hebben om de activeringsenergiebarrière te overwinnen die nodig is om een reactie te laten optreden.
2. Activeringsenergie:
* Activeringsenergiebarrière: Elke chemische reactie heeft een activeringsenergiebarrière, wat de minimale hoeveelheid energie is die nodig is om de reactie te verlopen.
* Temperatuur en het overwinnen van de barrière: Verhoogde temperatuur verhoogt het aandeel van moleculen dat voldoende energie bezit om de activeringsenergiebarrière te overwinnen.
3. De Arrhenius -vergelijking:
* De relatie kwantificeren: De relatie tussen temperatuur en reactiesnelheid wordt wiskundig beschreven door de Arrhenius -vergelijking:
`` `
k =a * exp (-Ea / rt)
`` `
waar:
* K is de snelheidsconstante
* A is de pre-exponentiële factor (gerelateerd aan botsingsfrequentie)
* EA is de activeringsenergie
* R is de ideale gasconstante
* T is de absolute temperatuur
* Exponentieel effect: De Arrhenius -vergelijking toont aan dat de snelheidsconstante (en dus de reactiesnelheid) exponentieel toeneemt met de temperatuur.
Samenvattend:
* Verhoogde snelheid: Hogere temperaturen leiden in het algemeen tot snellere reactiesnelheden als gevolg van verhoogde botsingsfrequentie, meer energetische botsingen en een groter deel van de moleculen die de activeringsenergiebarrière overwinnen.
* De "Rule of Thumb": Een algemene vuistregel is dat voor elke temperatuurstijging van 10 ° C de reactiesnelheid verdubbelt. Dit is echter slechts een benadering en de werkelijke toename kan aanzienlijk variëren, afhankelijk van de specifieke reactie.
Voorbeelden:
* Koken: Het koken van voedsel bij hogere temperaturen versnelt de chemische reacties die betrokken zijn bij het afbreken van voedselmoleculen, waardoor het sneller kookt.
* explosies: De snelle temperatuurstijging tijdens een explosie zorgt ervoor dat de reactie extreem snel optrad, wat leidt tot een grote afgifte van energie.
* Biologische reacties: De temperatuurgevoeligheid van enzymen, die biologische reacties katalyseren, is cruciaal voor het handhaven van optimale omstandigheden in levende organismen.
Laat het me weten als je dieper in een specifiek aspect van dit onderwerp wilt verdiepen!
 Welke verbinding vormen rubidium en broom, wat is de chemische formule?
Welke verbinding vormen rubidium en broom, wat is de chemische formule?  Wat zijn enkele kenmerken van polymeren?
Wat zijn enkele kenmerken van polymeren?  Onderzoek toont spontane zelforganisatie van microdruppels aan door middel van quasi eendimensionale opsluiting
Onderzoek toont spontane zelforganisatie van microdruppels aan door middel van quasi eendimensionale opsluiting  Afstembaar emissief organisch platform
Afstembaar emissief organisch platform Zijn zuren het gevaarlijkst wanneer ze geconcentreerd of verdund zijn?
Zijn zuren het gevaarlijkst wanneer ze geconcentreerd of verdund zijn?
Hoofdlijnen
- Wat is microtoxine?
- Hoe de taal van de Neanderthalers verschilde van de moderne mens:ze gebruikten waarschijnlijk geen metaforen
- Wetenschappers onthullen hoe een weinig bekende amoebe een bacterie overspoelde om fotosynthetisch te worden
- Habitat telt wanneer roofdieren op de loer liggen
- Dood aminozuur kankercellen?
- Kun je iemand echt doodsbang maken?
- Wat is geen manier om wetenschappelijke kennis op te doen?
- Wat eten orka's in het noordpoolgebied?
- Nieuwe aanwijzingen waarom mutaties in het MYH9-gen een breed spectrum aan aandoeningen bij mensen veroorzaken
- Dichte microgelsuspensies onthullen in-silico wat er gebeurt onder compressie
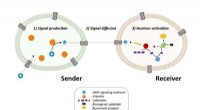
- Levensechte cellen kunnen nu over lange afstanden communiceren via signaalversterking
- Onderzoek toont aan dat het beter werken van één laag atomen op het oppervlak van een katalysator

- Onderzoek onthult een nieuwe manier om chirale katalysatoren te maken

- Dundee-lab lost HOIL-1-mysterie op

 Plakband:een belangrijk ingrediënt voor het in kaart brengen van de oorsprong van artefacten
Plakband:een belangrijk ingrediënt voor het in kaart brengen van de oorsprong van artefacten Hoe te berekenen Mollen uit moleculair gewicht
Hoe te berekenen Mollen uit moleculair gewicht  Galileo klaar voor lancering
Galileo klaar voor lancering Heeft het Golgi -apparaat een membraan?
Heeft het Golgi -apparaat een membraan?  Hoeveel liter diesel is in 207538 pond brandstof?
Hoeveel liter diesel is in 207538 pond brandstof?  Wat is het verschil tussen mengsel van aluminium en jodiumverbinding?
Wat is het verschil tussen mengsel van aluminium en jodiumverbinding?  Een patch die tegelijkertijd zes gezondheidsgerelateerde biomarkers meet door zweet te analyseren
Een patch die tegelijkertijd zes gezondheidsgerelateerde biomarkers meet door zweet te analyseren Verbreding van metaaltolerantie voor hydrogels
Verbreding van metaaltolerantie voor hydrogels
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

