
Wetenschap
De oplossing wordt bereid door 13,3 g ammoniumsulfaat op te lossen in voldoende water om 100,0 ml voorraadoplossing te maken. Een monster van 12,00 hieraan toegevoegd 57,00 Bereken de concentratie?
Gebruik hiervoor de concentratie van stamoplossing A en het toegevoegde monstervolume:
$$Molariteit =\frac{Moles}{Liter}$$
$$Molar =Molariteit \maal Liter$$
$$n =\frac{(13,3g/132,14 g/mol)}{0,1L}$$
$$n =0,1\mol/L$$
$$Mollen \ van \ NH_4SO_4 \ in \ 12,00 \ ml =(0,1000 mol/L) \times (12,00 ml) =0,001200 \ mol$$
Stap 2:Bereken het totale volume van de oplossing na toevoeging van 12,00 ml monster.
Het totale volume is 57,00 ml + 12,00 ml =69,00 ml
Stap 3:Bereken de nieuwe concentratie ammoniumsulfaat in de verdunde oplossing.
De nieuwe concentratie kan worden berekend met de formule:
$$M_1V_1 =M_2V_2$$
waarbij M1 de oorspronkelijke concentratie is, V1 het oorspronkelijke volume, M2 de nieuwe concentratie en V2 het nieuwe volume.
$$(0,1000 mol/L) \tijden (100,0 ml) =M_2 \tijden (69,00 ml)$$
$$M_2 =\frac{(0,1000 mol/L) \times (100,0 ml)}{69,00 ml} =0,0725 mol/L$$
Daarom is de nieuwe concentratie ammoniumsulfaat in de verdunde oplossing 0,0725 mol/l.
 Het regent PFAS:zelfs op Antarctica en op het Tibetaanse plateau is regenwater onveilig om te drinken
Het regent PFAS:zelfs op Antarctica en op het Tibetaanse plateau is regenwater onveilig om te drinken Trumps EPA verhuist om stralingslimieten te versoepelen
Trumps EPA verhuist om stralingslimieten te versoepelen Wereldwijde gezondheidsvoordelen van klimaatactie compenseren de kosten
Wereldwijde gezondheidsvoordelen van klimaatactie compenseren de kosten Een krabbenperspectief van opkomend tij in een veranderende wereld
Een krabbenperspectief van opkomend tij in een veranderende wereld Sinaasappelen verdorren, koeien lijden honger in het door droogte getroffen Sicilië
Sinaasappelen verdorren, koeien lijden honger in het door droogte getroffen Sicilië
Hoofdlijnen
- Wat gebeurt er met cellen als gevolg van een natriumonbalans?
- Welke stoffen passeren moeder en embryo?
- Stelt de celtheorie dat alle cellen voortkomen uit andere cellen?
- Wat maakt clowns zo griezelig?
- Hoe dieren getallen begrijpen, beïnvloedt hun overlevingskansen
- De meeste hondensnoepjes overschrijden de aanbevolen dagelijkse hoeveelheid energie
- Hebben vissen last van zuurstofgebrek?
- Welk element komt vooral voor in eiwitten en nucleïnezuren?
- Stichting om speciaal reservaat te creëren voor albino orang-oetan
- Onderzoekers beschrijven het volledige scala aan ceramiden dat wordt aangetroffen in de bovenste laag van de menselijke huid
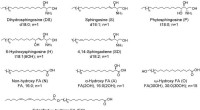
- Hydrogels met periodiek patroon:een model voor coöperatieve vervorming
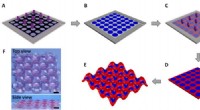
- Adsorberend materiaal ontwikkeld uit PET-flessen voor het verwijderen van antibiotica uit water
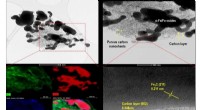
- Nieuwe antimicrobiële coating kan de sleutel zijn in de strijd tegen ziekenhuisinfecties

- Wetenschappers ontdekken pad naar verbetering van baanbrekende batterij-elektrode

 Wetenschappelijk computergebruik in de cloud komt op aarde
Wetenschappelijk computergebruik in de cloud komt op aarde Onderzoekers onthullen nieuwe zonnecel gemaakt van koolstofnanobuisjes die meer zonlicht omzet in energie
Onderzoekers onthullen nieuwe zonnecel gemaakt van koolstofnanobuisjes die meer zonlicht omzet in energie Studie toont het uitdoven van een antiferromagneet in toestanden met hoge weerstand aan
Studie toont het uitdoven van een antiferromagneet in toestanden met hoge weerstand aan Ooit voor onmogelijk gehouden, wetenschappers tonen aan dat vloeibaar water THz-golven kan genereren
Ooit voor onmogelijk gehouden, wetenschappers tonen aan dat vloeibaar water THz-golven kan genereren Iconische Old West-tumbleweeds komen binnen en bedekken delen van de buitenwijken van Salt Lake City
Iconische Old West-tumbleweeds komen binnen en bedekken delen van de buitenwijken van Salt Lake City  Zijn maatschappelijke bezwaren tegen windparken overdreven?
Zijn maatschappelijke bezwaren tegen windparken overdreven? Kunnen bedrijven ooit winst maken op ongewenste CO2?
Kunnen bedrijven ooit winst maken op ongewenste CO2?  Stukje bij beetje datarecords breken
Stukje bij beetje datarecords breken
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

