
Wetenschap
Wat is de osmolariteit van een 0,2M-oplossing KCL?
Om de osmolariteit van een oplossing te berekenen, moeten we rekening houden met het totale aantal deeltjes dat wordt bijgedragen door alle aanwezige opgeloste stoffen. In het geval van een 0,2M KCL-oplossing hebben we:
1 mol KCl → dissocieert in 1 mol K+-ionen en 1 mol Cl-ionen
Daarom is het totale aantal deeltjes dat wordt bijgedragen door 0,2 M KCl 0,2 mol/L K+-ionen + 0,2 mol/L Cl-ionen =0,4 mol/L.
Nu kunnen we direct de formule voor osmolariteit gebruiken:
Osmolariteit =Totale concentratie van deeltjes (in osmol/L)
In dit geval is de osmolariteit van een 0,2 M KCl-oplossing 0,4 Osm/L.
 Waarom is het optimaliseren ervan nog steeds zo moeilijk in een wereld die wordt gerund door katalysatoren?
Waarom is het optimaliseren ervan nog steeds zo moeilijk in een wereld die wordt gerund door katalysatoren?  Als een van de stikstofbasen zou worden vervangen door een andere base, welk effect zou dat dan kunnen hebben op de eiwitsynthese?
Als een van de stikstofbasen zou worden vervangen door een andere base, welk effect zou dat dan kunnen hebben op de eiwitsynthese?  Hoe de geleidbaarheid te berekenen vanwege concentratie
Hoe de geleidbaarheid te berekenen vanwege concentratie Hoe kunt u een klein lek van gasvormig chloor in de omgeving van een chlorinator detecteren?
Hoe kunt u een klein lek van gasvormig chloor in de omgeving van een chlorinator detecteren?  Nieuw productieproces voor polymeren bespaart 10 ordes van energie
Nieuw productieproces voor polymeren bespaart 10 ordes van energie
 Dakota pijpleidingbedrijf klaagt milieugroeperingen aan
Dakota pijpleidingbedrijf klaagt milieugroeperingen aan Waarom bloeit plankton? Het antwoord zou een heroverweging van het voedselweb van de oceaan kunnen afdwingen
Waarom bloeit plankton? Het antwoord zou een heroverweging van het voedselweb van de oceaan kunnen afdwingen  Ingenieurshoogleraar lost diep aardbevingsmysterie op
Ingenieurshoogleraar lost diep aardbevingsmysterie op Wetenschappers ontwikkelen een nieuwe manier om het magnetische veld van de aarde op afstand te meten
Wetenschappers ontwikkelen een nieuwe manier om het magnetische veld van de aarde op afstand te meten Speelde de aurora borealis een rol bij het tot zinken brengen van de Titanic?
Speelde de aurora borealis een rol bij het tot zinken brengen van de Titanic?
Hoofdlijnen
- Honingbijen ultra-verbonden door hun microbioom
- Kan een criticus die een gelovige is geworden, anderen beïnvloeden? Het geval van genetisch gemodificeerd voedsel
- Hoe vrije radicalen uw lichaam beïnvloeden
- Nieuw onderzoek toont aan dat micro-evolutie kan worden gebruikt om te voorspellen hoe evolutie op veel langere tijdschalen werkt
- Waarom zijn zoveel migrantenfamilies nog steeds gescheiden? Chaos in de gegevens
- Opnieuw beoordelen wat we van peptiden kunnen verwachten bij de detectie van ziekten
- Uitzoeken hoe planten het stikstofgebruik controleren
- Het bestuderen van circadiane ritmes in planten en hun ziekteverwekkers kan leiden tot precisiegeneeskunde voor mensen
- Kan biologische productie de drijvende kracht zijn achter de ontwikkeling in Afrika?
- Machine learning voorspelt mechanische eigenschappen van poreuze materialen
- Nieuwe techniek kan de productie van afval naar methaan versnellen

- Blaarvloeistof kan helpen bij het diagnosticeren van de ernst van brandwonden

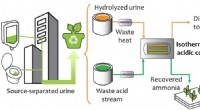
- Duurzame terugwinning van voedingsstoffen uit urine
- Onderzoek toont aan hoe de hechting tussen implantaten en bot kan worden verbeterd

 Zak met spiraalvormige oppervlaktepatronen vergemakkelijken de afgifte van stoffen
Zak met spiraalvormige oppervlaktepatronen vergemakkelijken de afgifte van stoffen De manier waarop een stad is georganiseerd, kan minder bevooroordeelde burgers opleveren
De manier waarop een stad is georganiseerd, kan minder bevooroordeelde burgers opleveren  80% van Indonesisch regenwoud kwetsbaar voor vernietiging van palmolie is niet beschermd
80% van Indonesisch regenwoud kwetsbaar voor vernietiging van palmolie is niet beschermd Nieuw machine learning-algoritme kan voorspellen hoe de raciale samenstelling van buurten zal veranderen
Nieuw machine learning-algoritme kan voorspellen hoe de raciale samenstelling van buurten zal veranderen  Waarom wordt het vaseline genoemd als het gemaakt is met vaseline en niet met wat olie?
Waarom wordt het vaseline genoemd als het gemaakt is met vaseline en niet met wat olie?  Energieafdeling wil snelle kernreactor bouwen
Energieafdeling wil snelle kernreactor bouwen Breek de bijlage voordat u uw spullen verkoopt, studie zegt:
Breek de bijlage voordat u uw spullen verkoopt, studie zegt: Kunnen taalmodellen het genoom lezen? Deze decodeerde mRNA om betere vaccins te maken
Kunnen taalmodellen het genoom lezen? Deze decodeerde mRNA om betere vaccins te maken
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

