
Wetenschap
Welke invloed heeft de temperatuur op het gas in een ballon?
Omgekeerd neemt de gemiddelde kinetische energie van de gasmoleculen af naarmate de temperatuur daalt, waardoor ze langzamer bewegen en de wanden van de ballon minder vaak en met minder kracht raken. Dit leidt tot een afname van de druk in de ballon, waardoor deze krimpt. In extreme gevallen kan de ballon zelfs instorten.
De relatie tussen temperatuur en gasdruk staat bekend als de wet van Charles, die stelt dat de druk van een gas recht evenredig is met de temperatuur ervan, ervan uitgaande dat het volume en de hoeveelheid gas constant blijven. Deze wet kan wiskundig worden uitgedrukt als:
```
P =k * T
```
Waar:
* P vertegenwoordigt de druk van het gas in atmosfeer (atm)
* k is een evenredigheidsconstante
* T vertegenwoordigt de temperatuur van het gas in Kelvin (K)
Door te begrijpen hoe de temperatuur het gas in een ballon beïnvloedt, kunnen we de grootte en vorm ervan bepalen voor verschillende toepassingen, zoals weerballonnen, feestballonnen en medische ballonnen.
 Hebben bodembedekkingsgewassen een negatieve invloed op rijgewassen?
Hebben bodembedekkingsgewassen een negatieve invloed op rijgewassen?  Hoe huizen tegen natuurbranden te beschermen is het onderwerp van het nieuwe boek van de professor
Hoe huizen tegen natuurbranden te beschermen is het onderwerp van het nieuwe boek van de professor  Opdoemende klimaateffecten:10 afhaalrestaurants uit het ontwerp-VN-rapport
Opdoemende klimaateffecten:10 afhaalrestaurants uit het ontwerp-VN-rapport Animals That Chirp at Night
Animals That Chirp at Night Opinie:Waarom vrouwen liever alleen in het bos zijn met een beer dan met mannen
Opinie:Waarom vrouwen liever alleen in het bos zijn met een beer dan met mannen
Hoofdlijnen
- Je bent niet wat je eet
- Microbiële ziekten en mutaties: wat is het ?, Lijsten & Oorzaken
- Wat zijn de belangrijkste onderdelen van de celcyclus?
- Waarom zijn er zo weinig vissen in de oceanen van de aarde?
- Ecologische successie: definitie, types, stadia en voorbeelden
- Hoe worden eiwitten in de cel gesorteerd? Onderzoeksteam lost deze tien jaar oude puzzel op
- Nieuw fossiel werpt licht op de evolutie van hoe dinosaurussen ademden
- Wetenschappers gebruiken robots om te onthullen hoe roofvissen omgaan met onvoorspelbare prooien
- Nieuwe studie laat zien hoe het Ebola-virus cellen infecteert
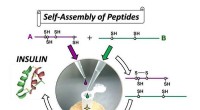
- Hoogrenderende synthese van insuline door op zelfassemblage gebaseerde organische chemie
- Geconjugeerde polymeren verbeteren massaspectrometrie en beeldvorming
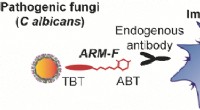
- Neutralisatie van pathogene schimmels met immunotherapeutica met kleine moleculen
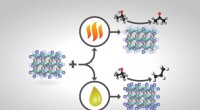
- Onderzoekers passen katalysatoren aan om productopbrengsten te verhogen, verlaag de scheidingskosten
- Serendipity verbreedt de mogelijkheden voor het maken van grafiet

 Ingrediënt in zeep kan de bevochtigbaarheid van uw huid veranderen
Ingrediënt in zeep kan de bevochtigbaarheid van uw huid veranderen Onderzoek toont aan waarom meteoroïden exploderen voordat ze de aarde bereiken
Onderzoek toont aan waarom meteoroïden exploderen voordat ze de aarde bereiken Hoe basisvaardigheden voor volwassenen te leren
Hoe basisvaardigheden voor volwassenen te leren Nieuw onderzoek om de voordelen van de natuur te behouden
Nieuw onderzoek om de voordelen van de natuur te behouden Hoe het Ionische percentage te berekenen als je eenmaal het elektronegativiteitsverschil hebt
Hoe het Ionische percentage te berekenen als je eenmaal het elektronegativiteitsverschil hebt Geen enkele zwarte wetenschapper heeft ooit een Nobelprijs gewonnen - dat is slecht voor de wetenschap, en slecht voor de samenleving
Geen enkele zwarte wetenschapper heeft ooit een Nobelprijs gewonnen - dat is slecht voor de wetenschap, en slecht voor de samenleving Waarom duurde het zo lang om Planeet Negen te 'ontdekken'?
Waarom duurde het zo lang om Planeet Negen te 'ontdekken'?  Hoe werkt lichtverspreiding?
Hoe werkt lichtverspreiding?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

