
Wetenschap
Waar reageert boor op?
1. Reactie met halogenen:Borium reageert met halogenen om covalente halogeniden te vormen. Wanneer boor bijvoorbeeld reageert met fluorgas (F2), vormt het boortrifluoride (BF3).
2. Reactie met zuurstof:Bij verhitting in lucht of in aanwezigheid van zuurstofgas vormt boor verschillende oxiden. Het kan bijvoorbeeld reageren met zuurstof om boortrioxide (B2O3) en diverse andere booroxiden te vormen.
3. Reactie met stikstof:Borium reageert bij hoge temperaturen met stikstofgas (N2) om boornitride (BN) te vormen. Boornitride heeft een gelaagde structuur die lijkt op grafiet en is een zeer stabiele verbinding.
4. Reactie met koolstof:Borium reageert met koolstof om boorcarbiden te vormen. Het reageert bijvoorbeeld met koolstof bij hoge temperaturen en vormt boorcarbide (B4C), een hard keramisch materiaal met een hoog smeltpunt.
5. Reactie met metalen:Borium kan met bepaalde metalen reageren om metaalboriden te vormen. Wanneer boor bijvoorbeeld reageert met aluminium, vormt het aluminiumboride (AlB2), dat wordt gebruikt als hogetemperatuurmateriaal in de lucht- en ruimtevaart- en auto-industrie.
De reactiviteit van boor kan variëren afhankelijk van de temperatuur en omstandigheden van de reactie. Het is doorgaans een niet-reactief element bij kamertemperatuur, maar wordt reactiever bij verhoogde temperaturen. De reacties van boor zijn van belang in verschillende industrieën en toepassingen, waaronder de metallurgie, keramiek, materialen voor hoge temperaturen, halfgeleiders en chemische synthese.
 Vervanging in de chemie opsommen en definiëren?
Vervanging in de chemie opsommen en definiëren?  Algoritme voor machinaal leren helpt bij het zoeken naar nieuwe medicijnen
Algoritme voor machinaal leren helpt bij het zoeken naar nieuwe medicijnen Hoe kernfusiereactoren werken
Hoe kernfusiereactoren werken  Hoe heet het fenomeen van emf-ontwikkeling tussen twee verschillende metalen die met elkaar in contact zijn gebracht?
Hoe heet het fenomeen van emf-ontwikkeling tussen twee verschillende metalen die met elkaar in contact zijn gebracht?  Hoeveel mol zit er in 97,2 gram boor?
Hoeveel mol zit er in 97,2 gram boor?
 Overstromingen door overblijfselen van tropische stormen vangen Phoenix-auto's op
Overstromingen door overblijfselen van tropische stormen vangen Phoenix-auto's op Heeft wonen in de buurt van windturbines een negatieve invloed op de menselijke gezondheid?
Heeft wonen in de buurt van windturbines een negatieve invloed op de menselijke gezondheid? Onderzoek toont aan dat milieuvriendelijk servies schadelijk is voor zeedieren
Onderzoek toont aan dat milieuvriendelijk servies schadelijk is voor zeedieren Open water vinden in de ijzige zeeën van Groenland
Open water vinden in de ijzige zeeën van Groenland Krachtige aardbeving in Filipijnen:1 doodt beschadigt huizen, wegen
Krachtige aardbeving in Filipijnen:1 doodt beschadigt huizen, wegen
Hoofdlijnen
- Deze spinnenetende, nestdelende vleermuis was ooit veilig voor vuur, totdat de Black Summer zijn regenwouden verbrandde
- Kan eten mensen gelukkig maken?
- Welke functie vervullen spillen tijdens mitose?
- Wat kikkerverkering ons kan vertellen over menselijke praatjes
- Wat is het verschil tussen Ribosoom en Ribosomaal DNA?
- Bioreactoren op een chip vernieuwen beloften voor algenbiobrandstoffen
- Hoe verschillende mierensoorten in hetzelfde territorium naast elkaar bestaan
- Kwallen hebben superkrachten - en andere redenen waarom ze hun slechte reputatie niet verdienen
- Cellen bij elkaar houden:hoe ons lichaam mechanische stress weerstaat
- Waarom zijn planten groen? Model van onderzoeksteams reproduceert fotosynthese

- Unieke organische lichtemitterende moleculaire emitters
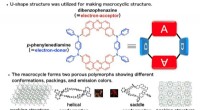
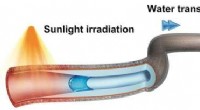
- Snel gecontroleerd transport van waterdruppels door door zonlicht aangedreven pomp
- Onderzoekers maken de eerste rietjes met polyhydroxyalkanoaat (PHA) plastic

- Ontdekking leidt tot nieuwe verouderingscrème en kippenvoer

 Hoe hPa naar Altitude te converteren
Hoe hPa naar Altitude te converteren  Hoe IRON MAN (IMA) betrokken is bij koperhomeostase-installaties
Hoe IRON MAN (IMA) betrokken is bij koperhomeostase-installaties  Hoe Vensterglas te maken
Hoe Vensterglas te maken  Geologen ontdekken hoe meer dan 2,6 Ga jaar oude rotsen werden gevormd in Limpopo Complex
Geologen ontdekken hoe meer dan 2,6 Ga jaar oude rotsen werden gevormd in Limpopo Complex Het aantal klimaatontkenners in Australië is meer dan het dubbele van het wereldwijde gemiddelde, nieuwe enquête vondsten
Het aantal klimaatontkenners in Australië is meer dan het dubbele van het wereldwijde gemiddelde, nieuwe enquête vondsten Lagere zuurstofniveaus om de oceanische voedselketen te beïnvloeden
Lagere zuurstofniveaus om de oceanische voedselketen te beïnvloeden Dieren en planten in de regio's van Georgië
Dieren en planten in de regio's van Georgië  Bij longitudinaal onderzoek gedroogde bloedvlekmonsters spelen een rol
Bij longitudinaal onderzoek gedroogde bloedvlekmonsters spelen een rol
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

