
Wetenschap
Wat is het verschil tussen ionische en covalente bindingen?
Ionische bindingen ontstaan wanneer er een volledige overdracht van elektronen van het ene atoom naar het andere plaatsvindt, wat resulteert in de vorming van positief geladen ionen (kationen) en negatief geladen ionen (anionen). De elektrostatische aantrekkingskracht tussen deze tegengesteld geladen ionen houdt de verbinding bij elkaar.
Kenmerken van ionische obligaties:
- Betrek een overdracht van elektronen, wat leidt tot de vorming van ionen.
- Sterke elektrostatische aantrekkingskracht tussen ionen.
- Verbindingen zijn doorgaans kristallijne vaste stoffen bij kamertemperatuur.
- Hoge smelt- en kookpunten als gevolg van sterke ionische interacties.
- Over het algemeen oplosbaar in polaire oplosmiddelen (bijvoorbeeld water), maar onoplosbaar in niet-polaire oplosmiddelen.
- Geleidt elektriciteit wanneer deze is opgelost of gesmolten, waardoor de beweging van ionen mogelijk is.
Covalente obligaties:
Covalente bindingen ontstaan wanneer twee of meer atomen elektronen delen om een stabiele elektronenconfiguratie te bereiken. De gedeelde elektronen bevinden zich tussen de atoomkernen en vormen zo een sterke binding.
Kenmerken van covalente obligaties:
- Betreft het delen van elektronen tussen atomen.
- Sterke aantrekkingskracht tussen atomen door gedeelde elektronenparen.
- Verbindingen kunnen bij kamertemperatuur voorkomen als vaste stoffen, vloeistoffen of gassen.
- Lagere smelt- en kookpunten vergeleken met ionische verbindingen.
- Over het algemeen onoplosbaar in polaire oplosmiddelen, maar oplosbaar in niet-polaire oplosmiddelen.
- Slechte geleiders van elektriciteit, behalve in speciale gevallen zoals metalen waarbij elektronen gedelokaliseerd zijn.
Samenvattend ligt het belangrijkste verschil tussen ionische en covalente bindingen in de aard van de elektronenoverdracht of -deling. Ionische bindingen omvatten volledige elektronenoverdracht en elektrostatische aantrekking tussen ionen, terwijl covalente bindingen het delen van elektronen tussen atomen inhouden om stabiliteit te bereiken. Deze verschillen leiden tot verschillende eigenschappen, zoals kristalstructuur, oplosbaarheid en elektrische geleidbaarheid.
 Onderzoeksteam reconstrueert motorvrachtcomplex voor ciliair transport
Onderzoeksteam reconstrueert motorvrachtcomplex voor ciliair transport Waarom heeft bismut een lager kookpunt dan antimoon?
Waarom heeft bismut een lager kookpunt dan antimoon?  Wetenschappers ontdekken een methode om coalescentie in niet-mengbare vloeistoffen te voorkomen
Wetenschappers ontdekken een methode om coalescentie in niet-mengbare vloeistoffen te voorkomen  Wat is het product van het samenvoegen van 2 glucosemoleculen?
Wat is het product van het samenvoegen van 2 glucosemoleculen?  Kan ik melk in een hydrietoplossing mengen?
Kan ik melk in een hydrietoplossing mengen?
 Versnelde temperatuurstijging in de Pyreneeën
Versnelde temperatuurstijging in de Pyreneeën Gegevens bevestigen groeiende dode zone in Chesapeake Bay
Gegevens bevestigen groeiende dode zone in Chesapeake Bay Wereldwijd rapport over plastic bedreigingen voor de oceaan
Wereldwijd rapport over plastic bedreigingen voor de oceaan Technologie voor kleine boerderijen vermindert ontbossing, klimaatverandering
Technologie voor kleine boerderijen vermindert ontbossing, klimaatverandering Over 100 jaar, misschien wordt ons voedsel niet in aarde gekweekt
Over 100 jaar, misschien wordt ons voedsel niet in aarde gekweekt
Hoofdlijnen
- Machine learning classificeert 191 van 's werelds meest schadelijke virussen
- Wat voor soort organisme is een plant?
- Vogelherkenning
- Wat is osmotische lyse?
- Hoe hebben wetenschappers ontdekt dat genen zijn gemaakt van DNA?
- Wetenschappers ontdekken hoe twee eiwitten helpen cellen gezond te houden
- Wetenschappers ontwikkelen een techniek om RNA-structuren in ultrahoge definitie te analyseren
- Hoe klonen werkt
- In de ruimte gekweekte vliegen vertonen een verzwakte immuniteit tegen schimmels
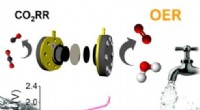
- Een lage prijs, hoogrenderende katalysator die koolstofdioxide omzet in andere chemicaliën
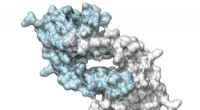
- Designer-enzym gebruikt onnatuurlijk aminozuur voor katalyse
- Keramische honingraatluchtfilters kunnen stadsvervuiling verminderen

- De betekenis van water in een veelbelovende biomarker tegen kanker

- Mantis garnalen dactyl clubs kunnen geheimen bevatten voor meer veerkrachtige oppervlakken voor menselijk gebruik

 Wat is herbeoefening?
Wat is herbeoefening?  Nieuw ontdekte dinosaurus onthult hoe T. rex koning van het Krijt werd
Nieuw ontdekte dinosaurus onthult hoe T. rex koning van het Krijt werd  Uitdagende Einsteins foto van Brownse beweging
Uitdagende Einsteins foto van Brownse beweging Radicaal eenvoudige techniek ontwikkeld om geleidende dunne films van polymeer te laten groeien
Radicaal eenvoudige techniek ontwikkeld om geleidende dunne films van polymeer te laten groeien De elektronische Griffiths-fase in fysieke systemen in vaste toestand
De elektronische Griffiths-fase in fysieke systemen in vaste toestand Wilde dieren werden routinematig gevangen en verhandeld in het oude Meso-Amerika
Wilde dieren werden routinematig gevangen en verhandeld in het oude Meso-Amerika Hoe kan de reactie met zuurstof worden gebruikt om een metaal van niet-metaal te onderscheiden?
Hoe kan de reactie met zuurstof worden gebruikt om een metaal van niet-metaal te onderscheiden?  Wat ontstaat er als een zuur reageert met een metaalhydroxide?
Wat ontstaat er als een zuur reageert met een metaalhydroxide?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

