
Wetenschap
Wat is de relatie tussen de snelheid van een reactie en de snelheid waarmee producten worden gevormd?
Er zijn een aantal factoren die de snelheid van een reactie kunnen beïnvloeden, waaronder:
* Temperatuur: Hoe hoger de temperatuur, hoe sneller de reactie zal plaatsvinden. Dit komt omdat hogere temperaturen meer energie aan de reactanten leveren, waardoor de kans groter is dat ze botsen en reageren.
* Concentratie: Hoe hoger de concentratie van de reactanten, hoe sneller de reactie zal plaatsvinden. Dit komt omdat er meer reactanten beschikbaar zijn die met elkaar kunnen botsen en reageren.
* Oppervlakte: Hoe groter het oppervlak van de reactanten, hoe sneller de reactie zal plaatsvinden. Dit komt omdat er meer reactanten beschikbaar zijn die met elkaar kunnen botsen en reageren.
* Katalysatoren: Katalysatoren zijn stoffen die de snelheid van een reactie versnellen zonder tijdens de reactie te worden verbruikt. Katalysatoren werken door een alternatieve route te bieden voor het plaatsvinden van de reactie, waarvoor minder energie nodig is dan de niet-gekatalyseerde reactie.
De relatie tussen de snelheid van een reactie en de snelheid waarmee producten worden gevormd, kan wiskundig worden uitgedrukt met behulp van de volgende vergelijking:
```
tarief =k[A]^n[B]^m
```
In deze vergelijking is de snelheid de verandering in de concentratie van de producten in de loop van de tijd, k is de snelheidsconstante, [A] en [B] zijn de concentraties van de reactanten, en n en m zijn de orden van de reactie met betrekking tot A en B, respectievelijk.
De volgorde van een reactie is een maatstaf voor hoe de reactiesnelheid verandert met de concentratie van de reactanten. Een eerste-orde reactie is een reactie waarbij de reactiesnelheid recht evenredig is met de concentratie van een van de reactanten. Een tweede-orde reactie is een reactie waarbij de reactiesnelheid recht evenredig is met de concentratie van twee van de reactanten.
De snelheidsconstante is een constante die afhangt van de temperatuur en de aard van de reactanten. De snelheidsconstante wordt gebruikt om de snelheid van een reactie te berekenen bij een gegeven temperatuur en concentratie van de reactanten.
 Welke soorten intermoleculaire krachten zijn aanwezig in een mengsel van calciumbromide en water?
Welke soorten intermoleculaire krachten zijn aanwezig in een mengsel van calciumbromide en water?  Waarom wordt chloroform gebruikt bij vloeibare ir-spectroscopie?
Waarom wordt chloroform gebruikt bij vloeibare ir-spectroscopie?  Welke algemene vergelijking toont een enkelvoudige verplaatsingsreactie?
Welke algemene vergelijking toont een enkelvoudige verplaatsingsreactie?  Nieuwe theorie voor hoe sneeuwvlokken groeien
Nieuwe theorie voor hoe sneeuwvlokken groeien Wat is het aantal protonen in argongas?
Wat is het aantal protonen in argongas?
 Wat zijn de kleuren in pauwenveren?
Wat zijn de kleuren in pauwenveren?  Tekenen van eerdere mega-bevingen in Californië tonen het gevaar van de Big One op San Andreas Fault
Tekenen van eerdere mega-bevingen in Californië tonen het gevaar van de Big One op San Andreas Fault Koraalrifoases bieden een sprankje hoop
Koraalrifoases bieden een sprankje hoop Waarom we gehaktballen groen moeten maken:Nieuw onderzoek onderstreept aanzienlijke voordelen voor het milieu
Waarom we gehaktballen groen moeten maken:Nieuw onderzoek onderstreept aanzienlijke voordelen voor het milieu  Het verschil tussen menselijke vlooien en hondenvlooien
Het verschil tussen menselijke vlooien en hondenvlooien
Hoofdlijnen
- Hoe uw immuunsysteem werkt
- 5 mensen die niet begraven kunnen blijven
- Kan pizzakruid winterbraakziekte voorkomen?
- Genetische barcodes worden gebruikt om cruciale populaties in een ecosysteem van koraalriffen te kwantificeren
- Wie ontdekte de nucleaire envelop?
- Deze vissen leven in vrieskoude wateren. Waarom worden er zoveel ziek?
- Wat hondeneigenaren moeten weten over leptospirose
- Vergelijk en vergelijk DNA en RNA
- Vertakking voor voedsel:hoe voedingsstoffen de bloedsomloop van vliegen hervormen
- Een op de longen geïnspireerd ontwerp verandert water in brandstof
- Video:Wat is er precies gebeurd in Tsjernobyl?

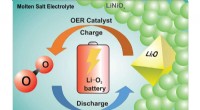
- Chemici maken doorbraak op weg naar het maken van een oplaadbare lithium-zuurstofbatterij
- Afvalhopstam in de bierindustrie upcycled tot nanovezels van cellulose

- Wetenschappers stellen een dynamische ladings- en oxidatietoestand voor voor katalysatoren met één atoom
 Ontdekken wat durian doet stinken
Ontdekken wat durian doet stinken  Hoe de iconische massale aanvallen van legermieren evolueerden
Hoe de iconische massale aanvallen van legermieren evolueerden  Hoe onderzoekers een decennia-oud mysterie met betrekking tot celvolume hebben opgelost
Hoe onderzoekers een decennia-oud mysterie met betrekking tot celvolume hebben opgelost  Privacyvrees weegt op Facebook met winst in het verschiet
Privacyvrees weegt op Facebook met winst in het verschiet Kunstmatige intelligentie helpt NASA's ogen op de zon te verbeteren
Kunstmatige intelligentie helpt NASA's ogen op de zon te verbeteren Omgaan met eco-angst
Omgaan met eco-angst Olifantenstroperij in Afrika neemt af, maar ivoorvangsten nemen toe:studie
Olifantenstroperij in Afrika neemt af, maar ivoorvangsten nemen toe:studie Nieuwe röntgenlasertechniek onthult magnetische skyrmion-fluctuaties
Nieuwe röntgenlasertechniek onthult magnetische skyrmion-fluctuaties
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

