
Wetenschap
Waarom wordt verlies van elektronen oxidatie genoemd?
In de moderne chemie wordt oxidatie gedefinieerd als het verlies van elektronen. Dit kan gebeuren wanneer een atoom of molecuul elektronen overdraagt aan een ander atoom of molecuul, of wanneer een atoom of molecuul elektronen verliest aan een extern elektrisch veld.
Het tegenovergestelde van oxidatie is reductie, wat wordt gedefinieerd als de versterking van elektronen.
De reden waarom verlies van elektronen oxidatie wordt genoemd, is omdat oxidatie in veel gevallen gepaard gaat met de toevoeging van zuurstof. Wanneer ijzer bijvoorbeeld roest, verliezen de ijzeratomen elektronen aan zuurstofatomen, waardoor ijzeroxide ontstaat.
Er zijn echter veel gevallen waarin bij oxidatie geen toevoeging van zuurstof nodig is. Wanneer koper bijvoorbeeld reageert met zoutzuur, verliezen de koperatomen elektronen aan waterstofatomen, waardoor koperchloride en waterstofgas worden gevormd.
Ondanks het feit dat bij oxidatie niet altijd de toevoeging van zuurstof betrokken is, wordt de term "oxidatie" vanwege zijn historische oorsprong nog steeds gebruikt om deze reacties te beschrijven.
Hier zijn enkele voorbeelden van oxidatie-reductiereacties:
* Verbranding: Wanneer een stof brandt, reageert deze met zuurstof en ontstaat warmte en licht. De zuurstofatomen halen elektronen uit de brandstof, die wordt geoxideerd.
* Roesten: IJzer roest als het in contact komt met zuurstof en water. De ijzeratomen verliezen elektronen aan zuurstofatomen en vormen ijzeroxide.
* Elektrolyse: Elektrolyse is het proces waarbij elektrische stroom wordt gebruikt om een verbinding in zijn samenstellende elementen te scheiden. De elektrode die elektronen verliest wordt geoxideerd, terwijl de elektrode die elektronen wint wordt verkleind.
Oxidatie-reductiereacties zijn essentieel voor veel biologische processen, zoals fotosynthese en ademhaling. Ze worden ook gebruikt in veel industriële processen, zoals de productie van staal en de raffinage van aardolie.
 Zeer selectieve terugwinning van lanthaniden via gelaagd vanadaat met zuur- en stralingsbestendigheid
Zeer selectieve terugwinning van lanthaniden via gelaagd vanadaat met zuur- en stralingsbestendigheid Wat zijn vijf polymeren in een huis?
Wat zijn vijf polymeren in een huis?  Onthulling van inaoside A:een antioxidant afgeleid van paddenstoelen
Onthulling van inaoside A:een antioxidant afgeleid van paddenstoelen  Onderzoekers ontwikkelen materialen voor quantum computing
Onderzoekers ontwikkelen materialen voor quantum computing Is nucleïnezuur covalent of ionisch?
Is nucleïnezuur covalent of ionisch?
 Hoe beïnvloedt het weer ons?
Hoe beïnvloedt het weer ons?
Weer, bewust of onbewust, beïnvloedt de dagelijkse keuzes die u maakt. Het helpt om te bepalen of je je kleedt om warm of koel te blijven, geniet van activiteiten buiten of blijf binnen - of evacueer naar een veilige pl
 Onderzoekers ontdekken dat nieuw blootgelegd Arctisch landschap een belangrijke rol speelt in de koolstofcyclus
Onderzoekers ontdekken dat nieuw blootgelegd Arctisch landschap een belangrijke rol speelt in de koolstofcyclus Pandemische maskerberg stelt nieuwe recyclinguitdaging
Pandemische maskerberg stelt nieuwe recyclinguitdaging NASA volgt een sterkere tropische storm Nock-Ten
NASA volgt een sterkere tropische storm Nock-Ten Bewijs opgraven voor de oorsprong van platentektoniek
Bewijs opgraven voor de oorsprong van platentektoniek
Hoofdlijnen
- Moderne genetische sequencing-instrumenten geven een duidelijker beeld van hoe koralen verwant zijn
- Hoe plantenhormonen de wortelgroei controleren
- Wat is de betekenis van h20 in de wetenschap?
- Wat betekent biografie?
- Hoe het herstellen van overvolle bossen meerdere uiteenlopende voordelen kan opleveren
- castratie van huisdieren vallen af tijdens pandemie, wat leidt tot overbevolking van opvangcentra
- Wat is een koolhydraat gevonden in een celwand van plantencellen?
- Slimme technologie helpt bij onderzoek naar een nationaal belangrijke zeevogelkolonie
- Kussende insecten, vector voor de ziekte van Chagas, voor het eerst met succes gen-editing
- Kooimoleculen fungeren als moleculaire zeven voor de scheiding van waterstofisotopen
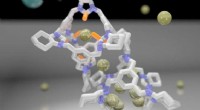
- Materiaalgradiënten kunnen polymeercomponenten versterken
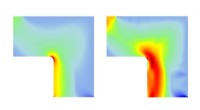
- Nauwkeurig gedefinieerde polymeerketens nu een realiteit

- Een duidelijk beeld schetsen van hoe stikstofoxiden worden gevormd

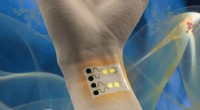
- Een draagbare gassensor voor gezondheids- en milieumonitoring
 Hoe het stadsontwerp van Teotihuacan werd verloren en gevonden
Hoe het stadsontwerp van Teotihuacan werd verloren en gevonden Studenten en creditcardschulden:ouders schuldig?
Studenten en creditcardschulden:ouders schuldig?  Iran claimt lancering van satellietdragende raket in de ruimte
Iran claimt lancering van satellietdragende raket in de ruimte 10 gekke toepassingen voor volledig wrijvingsloze oppervlakken
10 gekke toepassingen voor volledig wrijvingsloze oppervlakken  Mediterrane potvissen vertonen grote variaties in grootte
Mediterrane potvissen vertonen grote variaties in grootte  Onderzoek naar nieuw gesynthetiseerde thalliumverbindingen voor opto-elektronische apparaten
Onderzoek naar nieuw gesynthetiseerde thalliumverbindingen voor opto-elektronische apparaten Chinees ruimtelab valt in maart terug naar de aarde
Chinees ruimtelab valt in maart terug naar de aarde Beïnvloedt het geslacht van een broer of zus onze eigen persoonlijkheid? Een grote nieuwe studie geeft antwoord op een eeuwenoude vraag
Beïnvloedt het geslacht van een broer of zus onze eigen persoonlijkheid? Een grote nieuwe studie geeft antwoord op een eeuwenoude vraag
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

