
Wetenschap
Wat bepaalt de sterkte van een zuur?
1. Mate van dissociatie :De sterkte van een zuur is recht evenredig met de mate van dissociatie in water. Een sterk zuur dissocieert vrijwel volledig in water, waarbij een hoge concentratie waterstofionen (H+) vrijkomt. Aan de andere kant dissocieert een zwak zuur slechts gedeeltelijk, wat resulteert in een lagere concentratie H+-ionen.
2. Concentratie van hydroniumionen (H3O+): De sterkte van een zuur wordt gemeten in termen van de hydroniumionconcentratie, [H3O+]. Hoe hoger de [H3O+] van een oplossing, hoe sterker het zuur. Sterke zuren hebben een hogere [H3O+] dan zwakke zuren.
3. Ionisatieconstante (Ka): De ionisatieconstante Ka is een maat voor de mate waarin een zuur dissocieert in water. Het wordt uitgedrukt als de evenwichtsconstante voor de dissociatiereactie van het zuur. Een sterk zuur heeft een hoge Ka-waarde, wat wijst op een grotere neiging tot dissociëren, terwijl een zwak zuur een lage Ka-waarde heeft, wat duidt op een kleinere neiging tot dissociëren.
4. pH: De pH van een oplossing is een maatstaf voor de zuurgraad of basiciteit ervan. Het wordt bepaald door de concentratie van H3O+-ionen. Een sterk zuur heeft een lage pH (lager dan 7) vanwege de hoge [H3O+]-concentratie, terwijl een zwak zuur een hogere pH heeft (dichter bij 7) vanwege de lagere [H3O+]-concentratie.
Samenvattend wordt de sterkte van een zuur bepaald door de mate van dissociatie, de concentratie hydroniumionen ([H3O+]), de ionisatieconstante (Ka) en de resulterende pH van de oplossing. Sterke zuren hebben een hoge mate van dissociatie, hoge [H3O+], hoge Ka en lage pH, terwijl zwakke zuren een lage dissociatiegraad hebben, lage [H3O+], lage Ka en een pH dichter bij 7.
 Wat bepalen valentie-elektronen?
Wat bepalen valentie-elektronen?  Wat is de structuurformule van natriumnitriet?
Wat is de structuurformule van natriumnitriet?  Laserprinten op gevallen boombladeren produceert sensoren voor medisch en laboratoriumgebruik
Laserprinten op gevallen boombladeren produceert sensoren voor medisch en laboratoriumgebruik  Onderzoekers ontdekken C-H-bindingsactiveringsreacties bij lage temperatuur door foto-geïnduceerde middelen
Onderzoekers ontdekken C-H-bindingsactiveringsreacties bij lage temperatuur door foto-geïnduceerde middelen Waarom Soda Pop schone munten?
Waarom Soda Pop schone munten?
 Hoe verbeteren microscopen ons leven vandaag?
Hoe verbeteren microscopen ons leven vandaag?  Wetenschappers gebruiken nieuwe methoden om de beweging van koolstof in noordelijke terrestrische ecosystemen te onderzoeken
Wetenschappers gebruiken nieuwe methoden om de beweging van koolstof in noordelijke terrestrische ecosystemen te onderzoeken Het strandevenement in Bombay toont problemen aan bij het voorspellen van aardbevingen
Het strandevenement in Bombay toont problemen aan bij het voorspellen van aardbevingen Arctische afbraak:wat klimaatverandering in het hoge noorden betekent voor de rest van ons
Arctische afbraak:wat klimaatverandering in het hoge noorden betekent voor de rest van ons Onderzoek wijst uit hoe muggen zich aangetrokken voelden tot menselijke geuren
Onderzoek wijst uit hoe muggen zich aangetrokken voelden tot menselijke geuren
Hoofdlijnen
- Spier nodig voor een lastige plek? Ga over op vette stamcellen
- Wat is een methode om kopieën van DNA te maken?
- Welk organel vangt de energie van zonlicht op en zet deze om in een chemische stof in de vorm van glucose?
- Hoe het bewustzijn bij dieren onderzocht zou kunnen worden
- In welk bioom werken ontleders het meest efficiënt?
- Temperatuur kan de pollenkleur beïnvloeden
- Nieuwe mutaties in iPS-cellen zijn voornamelijk geconcentreerd in niet-transcriptionele regio's
- Zijn de wandaden van John James Audubon uit het verleden naar huis gekomen om te slapen?
- Hoe worden de individuele zakjes gevormd door het binnenmembraan genoemd?
- Lenen van de natuur om de kracht van de zon aan te boren

- Een blauw pigment dat een hoogwaardig ammoniakadsorbens blijkt te zijn
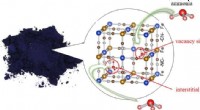
- Eerste 3D-geprinte proton-geleidende membraan effent de weg voor op maat gemaakte energieopslagapparaten

- Het potentieel van flexibele OLED's als innovatief oppervlaktemateriaal

- Wanneer het veranderen van één atoom moleculen beter maakt

 Hoe een ‘schaduwzone’ het oudste oceaanwater ter wereld vasthoudt
Hoe een ‘schaduwzone’ het oudste oceaanwater ter wereld vasthoudt  Dit is de beste plek voor ontdekkingsreizigers om ijs te oogsten op Mars
Dit is de beste plek voor ontdekkingsreizigers om ijs te oogsten op Mars Wat zijn de verschillende soorten atoommodellen?
Wat zijn de verschillende soorten atoommodellen?  Hoe bedreigde pandas
Hoe bedreigde pandas Hoe effectieve capaciteit en efficiëntie te berekenen
Hoe effectieve capaciteit en efficiëntie te berekenen 5 Aardse feiten om de geest van uw kind te verbazen
5 Aardse feiten om de geest van uw kind te verbazen  Wetenschappers ontdekken oorzaak van Atlantische kusten zeespiegelstijging hotspots
Wetenschappers ontdekken oorzaak van Atlantische kusten zeespiegelstijging hotspots De verrassende ecologie van stof ontrafelen
De verrassende ecologie van stof ontrafelen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

