
Wetenschap
Waarvan is de sterkte afhankelijk als een zuur afhankelijk is?
1. Mate van ionisatie:
- Hoe sterker het zuur, hoe vollediger het dissocieert of ioniseert in water, waardoor meer H+-ionen vrijkomen.
- De mate van ionisatie wordt gemeten aan de hand van de zuurdissociatieconstante (Ka). Een hogere Ka-waarde duidt op een sterker zuur, omdat het sterker dissocieert in water.
2. Concentratie van hydroniumionen (H3O+):
- De sterkte van een zuur is recht evenredig met de concentratie hydroniumionen die wordt geproduceerd wanneer het in water oplost.
- Sterke zuren produceren een hogere concentratie H3O+, terwijl zwakke zuren een lagere concentratie produceren.
3. pH-waarde:
- De pH-waarde van een oplossing is een maatstaf voor de zuurgraad of basiciteit ervan. Het wordt bepaald door de concentratie van H3O+-ionen.
- Sterke zuren hebben een lagere pH-waarde (wat wijst op een hogere zuurgraad) omdat ze meer H3O+-ionen vrijgeven, terwijl zwakke zuren een hogere pH-waarde hebben.
4. Structuur en elektronegativiteit:
- De chemische structuur en elektronegativiteit van het zuur spelen ook een rol bij het bepalen van de sterkte ervan.
- Zuren met meer elektronegatieve atomen, zoals zuurstof of fluor, zijn doorgaans sterker omdat ze effectiever elektronen uit de O-H-binding kunnen aantrekken, wat leidt tot een grotere afgifte van H+-ionen.
5. Temperatuur:
- Over het algemeen neemt de sterkte van een zuur toe met de temperatuur. Dit komt omdat hogere temperaturen meer energie opleveren om de krachten te overwinnen die de moleculen bij elkaar houden, wat resulteert in verhoogde ionisatie. Het effect van de temperatuur op de zuursterkte kan echter verbindingsspecifiek zijn.
6. Oplosmiddeleffecten:
- De sterkte van een zuur kan ook worden beïnvloed door het oplosmiddel waarin het is opgelost. Sommige oplosmiddelen, zoals water, hebben een hogere diëlektrische constante en kunnen ionen beter stabiliseren, wat de ionisatie bevordert en de sterkte van het zuur vergroot.
Deze factoren dragen gezamenlijk bij aan de sterkte van een zuur, bepalen het vermogen ervan om H+-ionen te doneren en de impact ervan op de zuurgraad van een oplossing.
 Het Duitse kabinet tekent plannen af om CO2-afvang mogelijk te maken
Het Duitse kabinet tekent plannen af om CO2-afvang mogelijk te maken  De 5 soorten fossielen
De 5 soorten fossielen Vooruitgang in supercomputers zal de analyse van de variabiliteit van het aardsysteem en de behoeften van de energiesector verbeteren
Vooruitgang in supercomputers zal de analyse van de variabiliteit van het aardsysteem en de behoeften van de energiesector verbeteren Boomringen kunnen de uitbarstingsdatum van de Thera-vulkaan bepalen
Boomringen kunnen de uitbarstingsdatum van de Thera-vulkaan bepalen Zwarte koolstof varieert, maar hardnekkig volhardt, in sneeuw en ijs over de hele wereld
Zwarte koolstof varieert, maar hardnekkig volhardt, in sneeuw en ijs over de hele wereld
Hoofdlijnen
- Zeeschildpadden sterven nadat ze verstrikt zijn geraakt in plastic afval
- Vrouwelijke wetenschappers die de wereld veranderden
- Celstructuren en hun drie belangrijkste functies
- Hoe boomsoorten zich aanpassen aan klimaatverandering
- Hoe smaakcellen de foerageerstrategie van een heel dier kunnen controleren
- Hoe de botten in het menselijk skelet te bestuderen
- Indringende vraag:Moet de samenleving reproductieve technologieën reguleren?
- Reduceren, hergebruiken, reflycleeren:hoe genetisch gemodificeerde vliegen afval kunnen verminderen en uit de stortplaatsen kunnen houden
- Let deze zomer op vossestaartzaaddozen die uw huisdier kunnen schaden
- Papier zonder microplastics:een economische en milieuvriendelijke coating

- Atomaire defectlijnen onderdrukken deactivering van ijzeroxidekatalysatoren
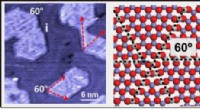
- Nieuwe experimentele strategie verheldert complexe kristalstructuur
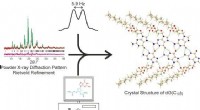
- Voedselkwaliteitscontrole sneller en gemakkelijker gemaakt

- Biologisch afbreekbare kunststoffen uit palmolieafval

 Kinesins negeren zwakke krachten omdat ze zware lasten dragen
Kinesins negeren zwakke krachten omdat ze zware lasten dragen Een hologramprojector maken
Een hologramprojector maken Het bestuderen van virale uitbraken in afzonderlijke cellen zou nieuwe manieren kunnen onthullen om ze te verslaan
Het bestuderen van virale uitbraken in afzonderlijke cellen zou nieuwe manieren kunnen onthullen om ze te verslaan Wat moet u doen als u het defecte gen heeft?
Wat moet u doen als u het defecte gen heeft?  Extreme weersomstandigheden kunnen stedelijke drainagesystemen maximaal belasten
Extreme weersomstandigheden kunnen stedelijke drainagesystemen maximaal belasten Afbeelding:Mysterieuze Zuidpoolformatie op Mars
Afbeelding:Mysterieuze Zuidpoolformatie op Mars Hoe kraken onderwatervulkanen en de Hawaiiaanse bocht verklaart
Hoe kraken onderwatervulkanen en de Hawaiiaanse bocht verklaart  Nieuwe studie toont terugtrekking van Oost-Antarctische ijskap tijdens eerdere warme periodes
Nieuwe studie toont terugtrekking van Oost-Antarctische ijskap tijdens eerdere warme periodes
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

