
Wetenschap
Wat wordt bedoeld met de oplosbaarheid van een opgeloste stof?
De maximale hoeveelheid opgeloste stof die bij een bepaalde temperatuur en druk in een bepaalde hoeveelheid oplosmiddel kan worden opgelost, staat bekend als de oplosbaarheid ervan. Het vertegenwoordigt de mate waarin een opgeloste stof oplost in een oplosmiddel om een homogeen mengsel of oplossing te vormen. De oplosbaarheid van een stof hangt af van verschillende factoren, zoals temperatuur, druk, aard van de opgeloste stof en het oplosmiddel, en de aanwezigheid van andere opgeloste stoffen of onzuiverheden.
Belangrijkste punten:
Maximale hoeveelheid:Oplosbaarheid verwijst naar de maximale hoeveelheid opgeloste stof die onder gedefinieerde omstandigheden in een specifieke hoeveelheid oplosmiddel kan worden opgelost.
Temperatuurafhankelijkheid:De oplosbaarheid van de meeste vaste stoffen in vloeistoffen neemt toe bij toenemende temperatuur. Naarmate de temperatuur stijgt, neemt de kinetische energie van de oplosmiddelmoleculen toe, waardoor hun vermogen om opgeloste deeltjes af te breken wordt vergroot en het oplossen wordt vergemakkelijkt.
Drukafhankelijkheid:Voor gassen opgelost in vloeistoffen neemt de oplosbaarheid toe met toenemende druk. Een hogere druk dwingt meer gasmoleculen in de vloeistof, wat resulteert in een hogere concentratie van het opgeloste gas.
Interacties tussen opgeloste stoffen en oplosmiddelen:De aard van de opgeloste stof en het oplosmiddel speelt een cruciale rol bij het bepalen van de oplosbaarheid. Hoe sterker de intermoleculaire krachten tussen opgeloste stof en oplosmiddeldeeltjes, hoe hoger de oplosbaarheid. Polaire opgeloste stoffen zijn doorgaans beter oplosbaar in polaire oplosmiddelen, terwijl niet-polaire opgeloste stoffen beter oplosbaar zijn in niet-polaire oplosmiddelen.
Verzadigingspunt:Wanneer een oplossing de maximaal mogelijke hoeveelheid opgeloste opgeloste stof bevat, wordt er gezegd dat deze verzadigd is. Op dit punt wordt het evenwicht tussen oplossen en neerslaan bereikt.
Effect van onzuiverheden:De aanwezigheid van onzuiverheden of extra opgeloste stoffen kan de oplosbaarheid van een stof beïnvloeden. Sommige onzuiverheden kunnen met de opgeloste stof concurreren om oplosmiddelmoleculen, waardoor de oplosbaarheid ervan wordt verminderd, terwijl andere de oplosbaarheid kunnen verbeteren door de eigenschappen van het oplosmiddel te veranderen.
Oplosbaarheidseenheden:Oplosbaarheid wordt vaak uitgedrukt in kwantitatieve termen, zoals gram opgeloste stof per 100 gram oplosmiddel (g/100 g) of mol opgeloste stof per liter oplosmiddel (mol/l).
Voorbeelden:
- Tafelzout (NaCl) heeft een hoge oplosbaarheid in water vanwege de sterke aantrekkingskracht tussen natrium- en chloride-ionen en watermoleculen.
- Suiker (sucrose) lost ook gemakkelijk op in water vanwege de vorming van waterstofbruggen tussen de hydroxylgroepen en watermoleculen.
- Zuurstofgas heeft een relatief lage oplosbaarheid in water bij kamertemperatuur en druk vergeleken met kooldioxide, dat beter oplosbaar is vanwege zijn polaire aard.
Samenvattend is oplosbaarheid een fundamentele eigenschap die bepaalt in welke mate een stof in een oplosmiddel kan worden opgelost. Het hangt af van verschillende factoren, waaronder temperatuur, druk, de aard van de opgeloste stof en het oplosmiddel, en de aanwezigheid van andere stoffen. Het begrijpen van de oplosbaarheid is essentieel op tal van wetenschappelijke gebieden, waaronder scheikunde, farmacie en milieuwetenschappen.
 Welke elementen maken aluminiumsulfaat?
Welke elementen maken aluminiumsulfaat?  Chemische vergelijking van ureum in de chemie?
Chemische vergelijking van ureum in de chemie?  Hoe de mal de kristallijne structuur van chocoladerepen beïnvloedt
Hoe de mal de kristallijne structuur van chocoladerepen beïnvloedt De vorm van de dingen die komen gaan:flexibel, opvouwbare supercondensatoren voor energieopslag
De vorm van de dingen die komen gaan:flexibel, opvouwbare supercondensatoren voor energieopslag Onderzoekers bevorderen stamceltherapie met biologisch afbreekbare steiger
Onderzoekers bevorderen stamceltherapie met biologisch afbreekbare steiger
 Europa maakt zich op voor recordbrekende hittegolf
Europa maakt zich op voor recordbrekende hittegolf Historische veranderingen in het Antarctisch ijs begrijpen, zou toekomstige veranderingen kunnen onthullen
Historische veranderingen in het Antarctisch ijs begrijpen, zou toekomstige veranderingen kunnen onthullen Kortstondige broeikasgassen veroorzaken eeuwenlange zeespiegelstijging
Kortstondige broeikasgassen veroorzaken eeuwenlange zeespiegelstijging Zandstorm overspoelt woestijnstad in China
Zandstorm overspoelt woestijnstad in China NASA ziet tropische storm Sonca aan land komen in Vietnam
NASA ziet tropische storm Sonca aan land komen in Vietnam
Hoofdlijnen
- Ontbrekende tenen van grizzlyberen resulteren in oproep om praktijken te veranderen
- Hoe verzamelen wetenschappers bewijsmateriaal om vragen te beantwoorden?
- Waarom ouders in hun beste jaren de beste nakomelingen voortbrengen
- Hoe zie je het verschil in chromosomen tussen moeder en vader?
- Onderzoek onderzoekt waarom mensen eerder van etniciteit veranderen
- Wat zijn verschillende bevolkingsgroepen?
- Onderzoekers ontdekken hoe griepvirussen menselijke cellen kapen
- Hoe is de taal geëvolueerd?
- Waarom heeft de moderne mens de Neanderthalers vervangen? De sleutel zou in onze sociale structuren kunnen liggen
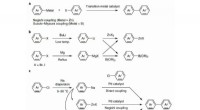
- Chemici tonen aan dat natrium veilig kan worden gebruikt voor kruiskoppelingsreacties
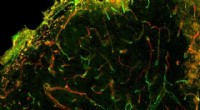
- Injecteerbare gel is veelbelovend als wondgenezend materiaal voor beroertes
- Kleurafstembare, zeer mobiele emitterende organische eenkristallen voor lichtemitterende transistors

- De wereld duurzaam van brandstof voorzien:ammoniak synthetiseren met minder energie

- Een zelfherstellende structurele kleurhydrogel geïnspireerd door de natuur

 Wat zijn de effecten van mijnbouw-smaragden?
Wat zijn de effecten van mijnbouw-smaragden?  Informatieopslag met een twist op nanoschaal
Informatieopslag met een twist op nanoschaal Kraaien kunnen opzettelijk plannen hoeveel telefoontjes ze moeten plegen, studieprogramma's
Kraaien kunnen opzettelijk plannen hoeveel telefoontjes ze moeten plegen, studieprogramma's  Bewustzijn is barrière voor plasticvrije periodes
Bewustzijn is barrière voor plasticvrije periodes Modellering van de jet van M87:waarom schijnen straaljagers van zwarte gaten en doorboren ze de kosmische hemel?
Modellering van de jet van M87:waarom schijnen straaljagers van zwarte gaten en doorboren ze de kosmische hemel?  Zonlicht krakende rotsen op Bennu
Zonlicht krakende rotsen op Bennu Het verschil tussen histon en nonhiston
Het verschil tussen histon en nonhiston  Nieuwe 3D-geprinte technologie verlaagt de kosten van algemene medische tests
Nieuwe 3D-geprinte technologie verlaagt de kosten van algemene medische tests
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

