
Wetenschap
Wat reageert snel met water en zuren?
Hier zijn enkele redenen waarom alkalimetalen snel reageren met water en zuren:
1. Lage ionisatie-energie: Alkalimetalen hebben lage ionisatie-energieën, wat betekent dat ze gemakkelijk hun buitenste elektron kunnen verliezen. Wanneer ze in contact komen met water of zuren, doneren ze dit elektron gemakkelijk, wat resulteert in een chemische reactie.
2. Hoge reactiviteit: Alkalimetalen zijn zeer reactief vanwege hun lage elektronegativiteit. Elektronegativiteit is een maatstaf voor het vermogen van een atoom om elektronen aan te trekken. Hoe minder elektronegatief een element is, hoe waarschijnlijker het is dat het elektronen verliest. Alkalimetalen hebben een lage elektronegativiteit, waardoor ze gevoeliger zijn voor het verliezen van elektronen en het ondergaan van chemische reacties.
3. Vorming van hydroxiden: Wanneer alkalimetalen met water reageren, vormen ze hydroxiden. Hydroxiden zijn zeer oplosbaar in water en dissociëren in hydroxide-ionen (OH-) en de overeenkomstige alkalimetaalionen (bijvoorbeeld LiOH, NaOH, KOH). De hydroxide-ionen kunnen verder reageren met zuren, wat leidt tot neutralisatiereacties.
4. Snelle reactie met zuren: Alkalimetalen reageren ook krachtig met zuren. Bij deze reacties doneert het alkalimetaal zijn elektron aan het waterstofion (H+) dat in het zuur aanwezig is, waardoor waterstofgas (H2) wordt gevormd. De reactie gaat vaak gepaard met het vrijkomen van een grote hoeveelheid warmte.
Hier zijn enkele specifieke voorbeelden van reacties tussen alkalimetalen en water of zuren:
Reactie met water:
- Lithium (Li) + Water (H2O) → Lithiumhydroxide (LiOH) + Waterstofgas (H2)
- Natrium (Na) + Water (H2O) → Natriumhydroxide (NaOH) + Waterstofgas (H2)
- Kalium (K) + Water (H2O) → Kaliumhydroxide (KOH) + Waterstofgas (H2)
Reactie met zuren:
- Lithium (Li) + Zoutzuur (HCl) → Lithiumchloride (LiCl) + Waterstofgas (H2)
- Natrium (Na) + Zwavelzuur (H2SO4) → Natriumsulfaat (Na2SO4) + Waterstofgas (H2)
- Kalium (K) + Salpeterzuur (HNO3) → Kaliumnitraat (KNO3) + Waterstofgas (H2)
De reacties van alkalimetalen met water of zuren zijn zeer exotherm, waarbij een aanzienlijke hoeveelheid warmte vrijkomt. Deze reacties kunnen gevaarlijk zijn en moeten onder gecontroleerde omstandigheden worden uitgevoerd.
 Moleculaire selfie onthult hoe een chemische binding verbreekt:men ziet hoe proton uit het molecuul ontsnapt
Moleculaire selfie onthult hoe een chemische binding verbreekt:men ziet hoe proton uit het molecuul ontsnapt  Gezonde organellen, gezonde cellen
Gezonde organellen, gezonde cellen Wetenschappers tonen aan dat puntdefecten in kathodekristallen de lithiumabsorptie kunnen versnellen
Wetenschappers tonen aan dat puntdefecten in kathodekristallen de lithiumabsorptie kunnen versnellen Zullen fluor en zwavel een ionische verbinding vormen?
Zullen fluor en zwavel een ionische verbinding vormen?  Verbetering van de schuimstabiliteit in desinfectiemiddelen met hoge ethanolconcentraties
Verbetering van de schuimstabiliteit in desinfectiemiddelen met hoge ethanolconcentraties
 Sombere voorspelling voor de Aletschgletsjer
Sombere voorspelling voor de Aletschgletsjer Enorme explosie doet St. Vincent op zijn kop staan terwijl vulkaan blijft uitbarsten
Enorme explosie doet St. Vincent op zijn kop staan terwijl vulkaan blijft uitbarsten Nieuw onderzoek laat zien hoe de vervuiling in Chicago per wijk verschilt
Nieuw onderzoek laat zien hoe de vervuiling in Chicago per wijk verschilt  Nieuwe studie suggereert verrassende rimpel in de geschiedenis van de West-Antarctische ijskap
Nieuwe studie suggereert verrassende rimpel in de geschiedenis van de West-Antarctische ijskap Duurzaam bouwen voor gebouwen
Duurzaam bouwen voor gebouwen
Hoofdlijnen
- Nieuw onderzoek laat zien hoe meer boeren kunnen worden betrokken bij het ontwerpen van nieuw milieubeleid
- Gregor Mendel - Vader van genetica: biografie, experimenten en feiten
- Wat is een eencellige eukaryoot?
- Microbiologen verbeteren de smaak van bier
- Eiwitten in haaientanden kunnen een aanwijzing zijn voor wat ze eten
- Wat is de taak van mitochondriën in een dierlijke cel?
- Het genennetwerk bepaalt hoeveel bloemen en vruchten planten zullen maken in het kritieke groeivenster
- Wat is celcompartimentering en waarom doet het zich voor?
- Waarom is het hoornvlies helder?
- Hoe met stikstof gedoteerde fluorescerende koolstofstippen bijdragen aan de strijd tegen ziekten
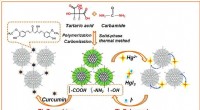
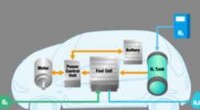
- Mobiliteit op waterstof komt dichterbij met brandstofcelsystemen van de volgende generatie
- Hoe kooldioxide uit de lucht te zuigen voor brandstoffen en meer?

- Met behulp van bacteriën uit warmwaterbronnen, biochemicus bestudeert RNA-splitsing bij mensen

- Mechanistische basis van zuurstofgevoeligheid in titanium

 Telescoop registreert enorme explosie op 12 miljard lichtjaar afstand
Telescoop registreert enorme explosie op 12 miljard lichtjaar afstand RoboBees gebruiken zonne-energie om te vliegen
RoboBees gebruiken zonne-energie om te vliegen  Vulkaan Alaska barst opnieuw uit stuurt aswolk over Aleoeten
Vulkaan Alaska barst opnieuw uit stuurt aswolk over Aleoeten Is er eerder enige vorm van exploratie op Mercurius gedaan
Is er eerder enige vorm van exploratie op Mercurius gedaan  Hoe kan een nevel uiteindelijk een zwart gat worden?
Hoe kan een nevel uiteindelijk een zwart gat worden?  Wat te doen op internet als de economie naar het zuiden gaat? van ellende biedt antwoord
Wat te doen op internet als de economie naar het zuiden gaat? van ellende biedt antwoord  Hoe olietank te berekenen Volume
Hoe olietank te berekenen Volume Onderzoekers ontdekken hoe sommige antibiotica bacteriën doden
Onderzoekers ontdekken hoe sommige antibiotica bacteriën doden
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

