
Wetenschap
Wat gebeurt er als zwavelzuur op een koperen plaat wordt gegoten?
1. Eerste contact:
Bij het gieten van geconcentreerd H2SO4 op de koperen plaat komt het zuur in contact met het metalen oppervlak.
2. Oxidatie:
Het geconcentreerde zuur werkt als een oxidatiemiddel en begint het kopermetaal te oxideren. Koper verliest elektronen en wordt omgezet in koper(II)-ionen (Cu2+).
3. Vorming van koper(II)sulfaat:
Terwijl de koperatomen oxidatie ondergaan, reageren ze met de in het zwavelzuur aanwezige sulfaationen (SO42-) om koper(II)sulfaat (CuSO4) te vormen. Deze verbinding is oplosbaar in water en valt uiteen in koperionen en sulfaationen.
4. Vrijkomen van zwaveldioxidegas:
Tijdens de reactie wordt zwaveldioxidegas (SO2) als bijproduct geproduceerd. Dit gas heeft een duidelijke, scherpe geur en kan de luchtwegen irriteren. De ontwikkeling van SO2-gas kan worden waargenomen als bellen die uit de reactieplaats opstijgen.
5. Hydratatie van koper(II)sulfaat:
Het bij de reactie gevormde koper(II)sulfaat is zeer oplosbaar in water. Terwijl het geconcentreerde zuur reageert met de koperplaat, nemen watermoleculen uit het zuur of de omgeving deel aan de hydratatie, waardoor gehydrateerd koper(II)sulfaat ontstaat. Deze verbinding verschijnt als helderblauwe kristallen.
6. Evolutie van waterdamp:
De reactie tussen zwavelzuur en koper leidt ook tot het vrijkomen van waterdamp. De hoge temperatuur die tijdens de reactie wordt gegenereerd, zorgt ervoor dat het water dat in het zuur of op de koperplaat aanwezig is, verdampt. Dit kan worden waargenomen als stoom die uit het reactiegebied opstijgt.
7. Verdere reacties:
Als de reactie langere tijd doorgaat, kan het geconcentreerde zwavelzuur beginnen te ontleden, waarbij extra gassen vrijkomen, zoals zwaveltrioxide (SO3) en zuurstof (O2).
8. Koperontbinding:
Naarmate de reactie vordert, lost de koperplaat geleidelijk op in het geconcentreerde zwavelzuur, waardoor een oplossing van koper (II) sulfaat ontstaat. De mate van oplossing hangt af van de concentratie van het zuur en de duur van de reactie.
Het is belangrijk op te merken dat deze reactie met voorzichtigheid moet worden uitgevoerd, omdat geconcentreerd zwavelzuur zeer corrosief is en ernstige brandwonden kan veroorzaken. Goede veiligheidsmaatregelen en beschermende uitrusting zijn essentieel bij het werken met dit zuur.
 Feiten voor kinderen op de blauwe Morpho Butterfly
Feiten voor kinderen op de blauwe Morpho Butterfly Hoe een groeiende bevolking gezond voedsel te geven zonder de planeet te verpesten?
Hoe een groeiende bevolking gezond voedsel te geven zonder de planeet te verpesten? Voorspelbaarheidslimiet:wetenschappers vinden grenzen aan weersvoorspelling
Voorspelbaarheidslimiet:wetenschappers vinden grenzen aan weersvoorspelling Zaadverspreiding in Mauritius – dood als een dodo?
Zaadverspreiding in Mauritius – dood als een dodo?  Onderzoek roept op tot terugdringing van congestie door minder wegen aan te leggen
Onderzoek roept op tot terugdringing van congestie door minder wegen aan te leggen
Hoofdlijnen
- Nieuwe technieken laten zien hoe microben de gezondheid en biodiversiteit van oceanen bepalen
- Waarom was frenologie een rage in de Victoriaanse tijd?
- Waarom zou besnijdenis het risico van een man om AIDS op te lopen verminderen?
- Wat is een eiwit? Een bioloog legt het uit
- Wat is osmoregulatie en waarom is het belangrijk in levende organismen?
- Wetenschappers laten zien hoe eiwitten de evolutionaire inzet verslaan
- Waar komt plastic vandaan?
- Wetenschappers ontdekken hoe ze monniksparkieten kunnen verslaan met hun eigen spel
- Uit onderzoek blijkt hoe lysozymeiwit in tranen gevaarlijke bacteriën vernietigt
- Universele pH-gereguleerde assemblage van DNA-nanostructuren
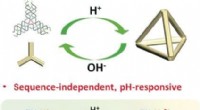
- Onderzoekers observeren de reactie van silicaatglas met waterige oplossingen in realtime

- De lengte van supramoleculaire polymeren regelen
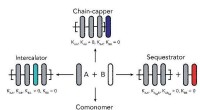
- Elastisch polymeer dat zowel stijf als taai is, lost al lang bestaand dilemma op

- Nabij-infrarood reflecterende mengcoatings hebben betere optische en koelprestaties

 Wat is de molariteit van een oplossing die 4,9 mol MgCl bevat in een totaal volume van 4,3 liter?
Wat is de molariteit van een oplossing die 4,9 mol MgCl bevat in een totaal volume van 4,3 liter?  Gekarakteriseerde medicijnen vertonen onverwachte effecten
Gekarakteriseerde medicijnen vertonen onverwachte effecten 5G komt eraan:wat kunnen we verwachten?
5G komt eraan:wat kunnen we verwachten? Hoe vliegtuigen werken
Hoe vliegtuigen werken  Hoe eieren hun vorm kregen:Aanpassingen voor de vlucht hebben mogelijk de variatie in eivorm bij vogels veroorzaakt
Hoe eieren hun vorm kregen:Aanpassingen voor de vlucht hebben mogelijk de variatie in eivorm bij vogels veroorzaakt  Wat voor soort energie heeft een helikopter?
Wat voor soort energie heeft een helikopter?  Zullen zuren litimuspapier rood kleuren?
Zullen zuren litimuspapier rood kleuren?  Afbeelding:MTG's FCI-instrument testen
Afbeelding:MTG's FCI-instrument testen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

