
Wetenschap
Wat vertegenwoordigt het atoomsymbool in een Lewis-structuur?
Het atoomsymbool biedt essentiële informatie over het element, inclusief de identiteit ervan en het aantal valentie-elektronen dat het bezit. Valentie-elektronen zijn de elektronen in de buitenste schil van een element die deelnemen aan chemische bindingen. Het aantal valentie-elektronen is cruciaal bij het bepalen van het chemische gedrag van het element en zijn vermogen om bindingen te vormen met andere atomen.
In een Lewis-structuur wordt het atoomsymbool gewoonlijk vergezeld van punten of kruisen die de valentie-elektronen voorstellen. Deze stippen of kruisen worden rond het atoomsymbool geplaatst om de rangschikking en verdeling van valentie-elektronen aan te geven. Door de Lewis-structuur en de plaatsing van punten of kruisen te onderzoeken, kan men begrijpen hoe de valentie-elektronen worden gedeeld, overgedragen of gepaard tussen atomen om een stabiele elektronenconfiguratie te bereiken.
Bovendien kan het atomaire symbool in een Lewis-structuur vergezeld gaan van een subscript of superscript om respectievelijk de isotoop of de ionische lading van het element te specificeren. "C-13" geeft bijvoorbeeld de koolstof-13-isotoop aan, terwijl "Na+" een positief geladen natriumion aangeeft. Deze notaties geven meer informatie over de specifieke atoomsoorten die betrokken zijn bij de Lewis-structuur.
Over het geheel genomen vertegenwoordigt het atomaire symbool in een Lewis-structuur het element zelf en dient het als een cruciaal onderdeel bij het begrijpen van de identiteit van het element, het aantal valentie-elektronen en het chemische bindingsgedrag binnen het molecuul of de verbinding die wordt weergegeven.
Hoofdlijnen
- Hoe empathie werkt
- Angiospermen: definitie, levenscyclus, soorten en voorbeelden
- Arabische gom van de Afrikaanse acaciabomen in de Sahel wordt in honderden producten gebruikt:wat is het waard om te weten
- Wat gorillapoep ons vertelt over evolutie en menselijke gezondheid
- Hoe markergenen in celclusters te vinden
- Hoe dichtheid de receptoractivatie op immuuncellen regelt
- Wat is de beste manier om de overdracht van tuberculose door in het wild levende runderen te voorkomen?
- Het bevorderen van de gewasveredeling door middel van gerichte genoommodificatie
- Onderzoekers ontdekken hoe 'zombiewormen' zich in skeletten boren
- Next-gen membranen voor het afvangen van koolstof
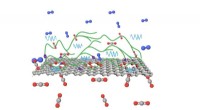
- Onderzoekers rapporteren nieuwe klasse polyethyleenkatalysator

- Onderzoekers ontwikkelen ultrasterke aerogels met materialen die worden gebruikt in kogelwerende vesten

- Zonnebrandstoffen werken goed onder druk

- Onderzoekers schetsen de huidige stand van zaken in de technologie van kalium-ionbatterijen
 NASA ziet Talim nu extra-tropisch
NASA ziet Talim nu extra-tropisch Robots niet kwaad, zegt Boston Dynamics terwijl mensachtigen viraal gaan
Robots niet kwaad, zegt Boston Dynamics terwijl mensachtigen viraal gaan Wat at T. rex? Elkaar
Wat at T. rex? Elkaar  Fotosynthese-copycat kan zonnecellen verbeteren
Fotosynthese-copycat kan zonnecellen verbeteren Voor de eerste keer, een ESA deep space-antenne bestuurde twee ruimtevaartuigen met één schotel
Voor de eerste keer, een ESA deep space-antenne bestuurde twee ruimtevaartuigen met één schotel Hoe zeemonsters werken
Hoe zeemonsters werken  Bosbranden, barbecueverboden:hittegolf verschroeit Europa
Bosbranden, barbecueverboden:hittegolf verschroeit Europa Een soort kunststof dat door middel van temperen van vorm kan veranderen
Een soort kunststof dat door middel van temperen van vorm kan veranderen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com


