
Wetenschap
Kan koolstof alleen polaire covalente bindingen vormen?
Koolstof kan zowel polaire als niet-polaire covalente bindingen vormen. Het type binding hangt af van de elektronegativiteit van de betrokken atomen. Niet-polaire covalente bindingen worden gevormd wanneer twee atomen vergelijkbare elektronegativiteiten hebben, zoals koolstof-koolstofbindingen. Polaire covalente bindingen worden gevormd wanneer het verschil in elektronegativiteit groter is dan 0,4 maar kleiner dan 1,7, zoals een koolstof-zuurstofbinding.
Hier zijn enkele voorbeelden van op koolstof gebaseerde moleculen en de soorten bindingen die ze vormen:
- Methaan (CH4) :Koolstof vormt vier niet-polaire covalente bindingen met vier waterstofatomen.
- Kooldioxide (CO2) :Koolstof vormt twee polaire covalente bindingen met twee zuurstofatomen.
- Ethanol (C2H5OH) :Koolstof vormt drie niet-polaire covalente bindingen met drie waterstofatomen en één polaire covalente binding met één zuurstofatoom.
- Aceton (CH3COCH3) :Koolstof vormt drie niet-polaire covalente bindingen met drie waterstofatomen, twee polaire covalente bindingen met twee zuurstofatomen en één covalente binding met een ander koolstofatoom.
 Chemici bedenken nieuwe Lewis-zuurtest met behulp van fluorescentie
Chemici bedenken nieuwe Lewis-zuurtest met behulp van fluorescentie Onderzoeksteam ontdekt hoe antibioticaresistente 'superbacteriën' kunnen worden gesaboteerd
Onderzoeksteam ontdekt hoe antibioticaresistente 'superbacteriën' kunnen worden gesaboteerd  Een onderzoek naar katalysatoren voor het synthetiseren van polyethyleen met ultrahoog molecuulgewicht
Een onderzoek naar katalysatoren voor het synthetiseren van polyethyleen met ultrahoog molecuulgewicht Wat is de meest voorkomende lading voor aardalkalimetalen?
Wat is de meest voorkomende lading voor aardalkalimetalen?  Nieuwe op hydraten gebaseerde methode is veelbelovend voor ontziltingstechnologie
Nieuwe op hydraten gebaseerde methode is veelbelovend voor ontziltingstechnologie
 Doorbraak in satellietbeeldvorming verbetert het vermogen om plantengroei te meten
Doorbraak in satellietbeeldvorming verbetert het vermogen om plantengroei te meten Aansteken met je boerenkool? Amazon gaat winkels openen in Whole Foods
Aansteken met je boerenkool? Amazon gaat winkels openen in Whole Foods  Opwarming van de aarde kan de beschikbaarheid van essentiële hersenvormende vetzuren bedreigen
Opwarming van de aarde kan de beschikbaarheid van essentiële hersenvormende vetzuren bedreigen Wat is er zo speciaal aan platina?
Wat is er zo speciaal aan platina?  Een sterke aardbeving doet het Indonesische Java-eiland schudden, maar er zijn geen berichten over slachtoffers
Een sterke aardbeving doet het Indonesische Java-eiland schudden, maar er zijn geen berichten over slachtoffers
Hoofdlijnen
- Team brengt in kaart hoe autofagie functioneert bij zoogdieren; SARS-CoV-2-infectie kan het proces verstoren
- Wat is het verschil tussen sporenmakers en zaadmakers?
- Hoe virussen werken
- Wat is de functie van vloeibaar wasmiddel bij genomische DNA-extractie?
- In welke drie industrieën worden bacteriën gebruikt?
- Wetenschappers tonen eerste 3D-afbeelding van antilichaamgen
- Algentoxine geproduceerd door brakwatersoorten gedetecteerd in Oder-water, natuurlijke oorzaken onwaarschijnlijk
- Steelhead-forel, ooit gedijend in Zuid-Californië, wordt bedreigd verklaard
- Hoe zijn virussen, viroïden en prionen verwant?
- Nieuwe fotogevoelige hydrogels ontwikkeld met oog voor biomedische toepassingen

- Nieuw onderzoek onthult potentieel voor systemen van synthetische materialen die hun grootte kunnen tellen en voelen
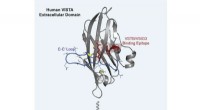
- Nieuw inzicht in een kankerbeschermend eiwit kan leiden tot een nieuwe generatie kankerbehandelingen
- Het nauwkeurig bepalen van de energieniveaus van verschillende zonnematerialen voor hoogwaardige apparaten

- Onderzoek onthult de chemische onderbouwing van hoe goedaardig water kan veranderen in hard waterstofperoxide

 Drugsjagers bewapenen, scheikundigen ontwerpen nieuwe reactie voor medicijnontdekking
Drugsjagers bewapenen, scheikundigen ontwerpen nieuwe reactie voor medicijnontdekking Wat gebeurt er met hun parasieten als gastheren uitsterven?
Wat gebeurt er met hun parasieten als gastheren uitsterven?  Geen inkt nodig:papier kan bedrukt worden met licht
Geen inkt nodig:papier kan bedrukt worden met licht Methode voor het opslaan van monsters kan de gezondheidszorg in regio's met beperkte middelen verbeteren
Methode voor het opslaan van monsters kan de gezondheidszorg in regio's met beperkte middelen verbeteren SoftBank Group boekt ergste kwartaalverlies Zoon geeft slechte beslissingen toe
SoftBank Group boekt ergste kwartaalverlies Zoon geeft slechte beslissingen toe TouchMath gebruiken
TouchMath gebruiken  Analyse van oude tanden onthult aanwijzingen over hoe sociaal-politieke systemen groeien
Analyse van oude tanden onthult aanwijzingen over hoe sociaal-politieke systemen groeien Voel je je gelukkig? Hoe bijgeloof de keuze van de consument beïnvloedt
Voel je je gelukkig? Hoe bijgeloof de keuze van de consument beïnvloedt
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

