
Wetenschap
Hoe ontdek je de valentieschil en elektronen?
De valentieschil van een atoom is de buitenste bezette elektronenschil. Het is de schil die deelneemt aan de chemische binding en de chemische eigenschappen van een atoom bepaalt.
Om de valentieschil van een atoom te vinden:
1. Kijk naar het atoomnummer van het element.
2. Het aantal elektronenschillen is gelijk aan het periodenummer.
3. De valentie-elektronen bevinden zich op de buitenste schil.
Uitzonderingen:
Voor overgangsmetalen omvat de valentieschil de buitenste schil (n) en de volgende buitenste schil (n-1), omdat de d-orbitalen in de n-1-schil ook betrokken zijn bij binding.
Bijvoorbeeld:IJzer (Fe) heeft een atoomnummer van 26. Het bevindt zich in de 4e periode. Het heeft dus vier elektronenschillen. De valentieschil is de 4e schil, die 2 elektronen bevat. De derde schil heeft ook 8 elektronen, maar het zijn geen valentie-elektronen omdat ze zich in de d-orbitaal bevinden.
Voor edelgassen is de valentieschil de buitenste schil, maar deze is gevuld met elektronen. Dit maakt ze zeer stabiel en niet-reactief.
Bijvoorbeeld:Helium (He) heeft een atoomnummer van 2. Het bevindt zich in de 1e periode. Het heeft dus één elektronenschil. De valentieschil is de eerste schil, die 2 elektronen bevat. Dit maakt helium tot een edelgas.
Valentie-elektronen:
Valentie-elektronen zijn de elektronen in de valentieschil. Ze zijn verantwoordelijk voor de chemische eigenschappen en het bindingsgedrag van een atoom.
Om het aantal valentie-elektronen van een atoom te vinden:
Kijk naar het groepsnummer van het element in het periodiek systeem.
Het groepsnummer vertelt u het aantal valentie-elektronen.
Uitzonderingen:
Voor elementen in de groepen 3 tot en met 12 is het aantal valentie-elektronen gelijk aan het groepsnummer.
Bijvoorbeeld:Koolstof (C) zit in groep 4. Het heeft dus 4 valentie-elektronen.
Voor elementen in de groepen 13 tot en met 17 is het aantal valentie-elektronen gelijk aan 10 minus het groepsnummer.
Bijvoorbeeld:Stikstof (N) zit in groep 15. Het heeft dus 5 valentie-elektronen (10 - 15 =5).
Voor overgangsmetalen is het aantal valentie-elektronen gelijk aan het groepsnummer, maar sommige ervan kunnen zich in de d-orbitalen van de op één na buitenste schil bevinden.
Bijvoorbeeld:IJzer (Fe) zit in groep 8. Het heeft dus 8 valentie-elektronen, maar 2 daarvan bevinden zich in de d-orbitaal van de 3e schil.
Hoofdlijnen
- Waarom hebben bladcellen zoveel bladgroenkorrels?
- Onderzoek onderzoekt waarom mensen eerder van etniciteit veranderen
- Typen biologie-experimenten
- Chemici, biologen, archeologen:wie zal de recepten van onze voorouders opgraven?
- Nieuw onderzoek laat zien hoe parasieten complexe voedselwebben vormen
- Hoe planten hun symbiotische partners vinden
- El Nino in de Stille Oceaan heeft invloed op dolfijnen in West-Australië
- Wrens-oproepen onthullen subtiele verschillen tussen ondersoorten
- Invasieve kikkers geven invasieve vogels een boost op Hawaï
- Een lasertechniek blijkt effectief om materiaal terug te winnen dat is ontworpen om industriële producten te beschermen

- Zullen de futures-superbatterijen van zeewater worden gemaakt?
- Onderzoekers ontwerpen nieuwe moleculen die de brandstofefficiëntie verhogen

- Gebruik maken van de slagvastheid van 's werelds hardste beton voor rampenpreventie
- Scheidingslijn
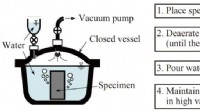
 Verbetering van de weersvoorspelling met een nieuwe IASI-kanaalselectiemethode
Verbetering van de weersvoorspelling met een nieuwe IASI-kanaalselectiemethode Snellere LED's voor draadloze communicatie van onzichtbaar licht
Snellere LED's voor draadloze communicatie van onzichtbaar licht Waterstofauto's voor de massa een stap dichter bij de realiteit, dankzij UCLA-uitvinding
Waterstofauto's voor de massa een stap dichter bij de realiteit, dankzij UCLA-uitvinding Groene katalysatoren met aardrijke metalen versnellen de productie van biobased plastic
Groene katalysatoren met aardrijke metalen versnellen de productie van biobased plastic Standpunt:Waarom ik de fouten van mijn vroege onderzoek rechtzet en wetenschappelijke gegevens deel met lokale gemeenschappen
Standpunt:Waarom ik de fouten van mijn vroege onderzoek rechtzet en wetenschappelijke gegevens deel met lokale gemeenschappen  In het ei leren Amerikaanse brulkikkers hoe ze kunnen voorkomen dat ze een lunch worden
In het ei leren Amerikaanse brulkikkers hoe ze kunnen voorkomen dat ze een lunch worden  Waarom kookt voedsel sneller in een snelkookpan?
Waarom kookt voedsel sneller in een snelkookpan?  Hoe krijg je een expomarker van een vel?
Hoe krijg je een expomarker van een vel?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com


