
Wetenschap
Wat is het volume in liters van 0,100 g C2H2F4-damp bij 0,0928 ATM en 22,3C?
$$PV =nRT$$
waar:
* P is de druk in atmosfeer (atm)
* V is het volume in liters (L)
* n is het aantal mol gas
* R is de ideale gasconstante (0,08206 L atm / mol K)
* T is de temperatuur in Kelvin (K)
Eerst moeten we het aantal mol C2H2F4-damp berekenen:
$$n =\frac{m}{M}$$
waar:
* m is de massa van het gas in gram (g)
* M is de molaire massa van het gas in gram per mol (g/mol)
De molaire massa van C2H2F4 is:
$$M =2(12,01 \ g/mol) + 2(1,01 \ g/mol) + 4(19,00 \ g/mol) =64,06 \ g/mol$$
Het aantal mol C2H2F4-damp is dus:
$$n =\frac{0,100 \ g}{64,06 \ g/mol} =0,001561 \ mol$$
Nu kunnen we de waarden van P, n, R en T vervangen door de ideale gaswet om het volume te berekenen:
$$V =\frac{nRT}{P}$$
$$V =\frac{(0,001561 \ mol)(0,08206 \ L atm / mol K)(295,45 \ K)}{0,0928 \ atm}$$
$$V =0,404 \ L$$
Daarom is het volume van 0,100 g C2H2F4-damp bij 0,0928 atm en 22,3°C 0,404 liter.
 Hoe zet je acetyleen om in ethanol?
Hoe zet je acetyleen om in ethanol?  Wat is het wetenschappelijke veiligheidssymbool voor het nooit proeven of ruiken van een onbekende stof?
Wat is het wetenschappelijke veiligheidssymbool voor het nooit proeven of ruiken van een onbekende stof?  Hoe de dikke darm prioriteit geeft aan gasontgifting boven energieverbruik?
Hoe de dikke darm prioriteit geeft aan gasontgifting boven energieverbruik? Onderzoekers ontdekken dat moleculen dynamisch omslaan van magnetische naar niet-magnetische vormen
Onderzoekers ontdekken dat moleculen dynamisch omslaan van magnetische naar niet-magnetische vormen Beheers de chaos om keramiek met hoge entropie te maken
Beheers de chaos om keramiek met hoge entropie te maken
 Forest Service-wetenschap verbetert de voorspelling van brandweer
Forest Service-wetenschap verbetert de voorspelling van brandweer Gevaarlijke verontreinigende stoffen op stortplaatsen gerangschikt in volgorde van toxiciteit
Gevaarlijke verontreinigende stoffen op stortplaatsen gerangschikt in volgorde van toxiciteit Wetenschappers sluiten dreigende door de zon veroorzaakte afkoeling van het klimaat uit
Wetenschappers sluiten dreigende door de zon veroorzaakte afkoeling van het klimaat uit Studie van eerdere opwarmingssignalen grote zeespiegelstijging in het verschiet
Studie van eerdere opwarmingssignalen grote zeespiegelstijging in het verschiet Hoe het milieu is veranderd sinds de eerste aardedag 51 jaar geleden
Hoe het milieu is veranderd sinds de eerste aardedag 51 jaar geleden
Hoofdlijnen
- Walvisontmoetingen in Mexico benadrukken de noodzaak van wereldwijde investeringen in onderzoek naar bultruggen
- Wetenschappers leren hoe planten met meerdere genen zich voortplanten
- Wat is een celmembraan?
- Hoe maak je een Paper Mache Cell
- Wetenschappers onthullen superbugs-artillerie
- Waarom vriezen vissen niet dood in ijskoud water?
- Team ontdekt hoe een eiwit zijn weg vindt
- Onderzoek biedt een wetenschappelijke verklaring voor de reden waarom afgewezen mannen hun verkeringspogingen opgeven
- In de ruimte gekweekte vliegen vertonen een verzwakte immuniteit tegen schimmels
- Elektrofotokatalytische diaminatie van vicinale C-H-bindingen
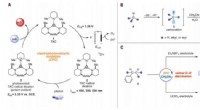
- Materiaalwetenschappers bouwen een synthetisch systeem met compartimenten zoals echte cellen
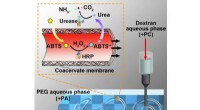
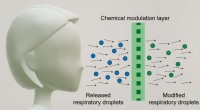
- Gezichtsmasker is bedoeld om het virus te deactiveren om anderen te beschermen
- Licht schijnen op een vloeistof verandert de diëlektrische permittiviteit volledig

- Biocompatibel binair hologram met mogelijkheden voor medicijnelutie

 De tekenen en symptomen van hoge radonniveaus in uw huis
De tekenen en symptomen van hoge radonniveaus in uw huis Nieuw onderzoek vindt manieren om de nauwkeurigheid van laterale flowtests te verbeteren
Nieuw onderzoek vindt manieren om de nauwkeurigheid van laterale flowtests te verbeteren Nieuwe methode voor bouwen op atomaire schaal
Nieuwe methode voor bouwen op atomaire schaal Een nieuwe manier om energie te meten in microscopisch kleine machines
Een nieuwe manier om energie te meten in microscopisch kleine machines Een meteoor kan in de lucht zijn geëxplodeerd 3, 700 jaar geleden, gemeenschappen in de buurt van de Dode Zee vernietigen
Een meteoor kan in de lucht zijn geëxplodeerd 3, 700 jaar geleden, gemeenschappen in de buurt van de Dode Zee vernietigen Onderzoek toont aan dat standaardkeuzes ertoe doen, vooral voor armere, lager opgeleide personen
Onderzoek toont aan dat standaardkeuzes ertoe doen, vooral voor armere, lager opgeleide personen Hoe het Europa vergaat met de doelstellingen voor hernieuwbare energie
Hoe het Europa vergaat met de doelstellingen voor hernieuwbare energie Satellieten met hoge resolutie gebruiken om de opbrengst van Afrikaanse boeren te meten
Satellieten met hoge resolutie gebruiken om de opbrengst van Afrikaanse boeren te meten
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

