
Wetenschap
Wat vergelijkt en contrasteert een waterstofion-hydroxide-ion?
- Positief geladen deeltje
- Vormt zich wanneer een waterstofatoom zijn elektron verliest
- Heeft een lage massa en een klein formaat
- Zeer reactief en kan gemakkelijk bindingen vormen met andere atomen
- Fungeert als protondonor bij chemische reacties
- Gevonden in zuren, wat bijdraagt aan hun zure eigenschappen
Hydroxide-ion (OH-):
- Negatief geladen deeltje
- Vormt zich wanneer een zuurstofatoom een elektron krijgt
- Heeft een hogere massa en een grotere omvang vergeleken met een waterstofion
- Ook zeer reactief en kan gemakkelijk bindingen vormen met andere atomen
- Werkt als protonacceptor bij chemische reacties
- Gevonden in basen, wat bijdraagt aan hun basiseigenschappen
Vergelijking:
- Zowel waterstofionen als hydroxide-ionen zijn geladen deeltjes en zijn cruciaal voor het begrijpen van de zuur-base-chemie.
- Ze zijn beide betrokken bij protonenoverdrachtsreacties, waarbij waterstofionen protondonoren zijn en hydroxide-ionen protonacceptoren.
- Waterstofionen en hydroxide-ionen kunnen zich in gelijke hoeveelheden combineren om water (H2O) te vormen via een neutralisatiereactie.
Contrast:
- Waterstofionen hebben een positieve lading, terwijl hydroxide-ionen een negatieve lading hebben.
- Waterstofionen zijn veel kleiner in vergelijking met hydroxide-ionen vanwege hun gebrek aan elektronen.
- Waterstofionen worden aangetroffen in zure oplossingen, terwijl hydroxide-ionen worden aangetroffen in basische oplossingen.
- De concentratie waterstofionen en hydroxide-ionen in een oplossing bepaalt de zuurgraad of basiciteit ervan.
Samenvattend zijn waterstofionen en hydroxide-ionen essentieel in de studie van de zuur-base-chemie. Ze bezitten contrasterende kenmerken zoals lading, grootte en hun aanwezigheid in zure of basische oplossingen.
 Biochemische netwerken van levens kunnen spontaan op aarde zijn gevormd
Biochemische netwerken van levens kunnen spontaan op aarde zijn gevormd Ontwikkeling van een zeer duurzame enkel-atomige katalysator met behulp van industriële luchtbevochtiger
Ontwikkeling van een zeer duurzame enkel-atomige katalysator met behulp van industriële luchtbevochtiger Hoe onderscheidt titratie zich van colorimetrie?
Hoe onderscheidt titratie zich van colorimetrie?  Praktisch gebruik van Distillation
Praktisch gebruik van Distillation  Wat zijn de voorbeelden van landbouw waarbij chemie helpt?
Wat zijn de voorbeelden van landbouw waarbij chemie helpt?
Hoofdlijnen
- DNA-bewijs onthult twee vergeten Noord-Amerikaanse migraties
- Wat is wetenschappelijk aan make-up?
- Syngenta schikt Amerikaanse boerenrechtszaken in Chinese maïshandelzaak
- Netwerken gebruiken om weefselspecifieke genregulatie te begrijpen
- Wetenschappers onthullen hoe SID-1 dsRNA herkent en systemische RNA-interferentie initieert
- Wie zou er winnen in een gevecht tussen een grote witte haai en een blauwe vinvis?
- Noorse rechtbank verleent uitstel aan zeven wolven
- Druk jezelf uit:hoe zygoten ingeprent genen uitzoeken
- Hoe zeer resistente schimmelsoorten ontstaan
- Wetenschappers tonen aan dat een veelbelovende vaste elektrolyt hydrofoob is
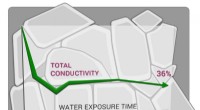
- Nieuwe isomere vinyleen-gekoppelde covalente organische raamwerken ontwikkeld met duidelijke fotokatalytische eigenschappen
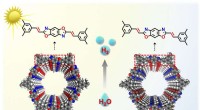
- Ontkoppeling van elektronisch en thermisch transport

- Efficiënte waterstofconversie door splitsing van water door zonne-energie met behulp van op hematiet-mesocrystal gebaseerde fotoanodes
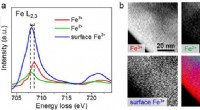
- Een niet-giftig alternatief voor gekleurde rook creëren

 117 jaar later, de storm die Galveston vernietigde
117 jaar later, de storm die Galveston vernietigde Hoe zijn meer stuifmeelkorrels belangrijk in termen van reproductief succes?
Hoe zijn meer stuifmeelkorrels belangrijk in termen van reproductief succes?  Hoe een one night stand in de ijstijd ons allemaal vandaag de dag beïnvloedt
Hoe een one night stand in de ijstijd ons allemaal vandaag de dag beïnvloedt  Hoe het leven online jongeren beïnvloedt
Hoe het leven online jongeren beïnvloedt Snel bestuurbaar, kleine magnetische stukjes
Snel bestuurbaar, kleine magnetische stukjes Hoe effectieve nucleaire lading te berekenen
Hoe effectieve nucleaire lading te berekenen Wat big data onthult over online extremisme
Wat big data onthult over online extremisme Degradatie van zonnecellen voor het eerst direct waargenomen
Degradatie van zonnecellen voor het eerst direct waargenomen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

