
Wetenschap
Wat zijn de niet-Welke van deze is geen type chemische binding?
Een chemische binding is een blijvende aantrekkingskracht tussen atomen, ionen of moleculen die de vorming van chemische verbindingen mogelijk maakt. Het type chemische binding hangt af van het verschil in elektronegativiteit van de betrokken atomen en de elektronische structuur van het molecuul als geheel.
Er zijn drie hoofdtypen chemische bindingen:ionische, covalente en metallische bindingen.
- Ionische bindingen worden gevormd wanneer een of meer elektronen van het ene atoom naar het andere worden overgebracht, waardoor tegengesteld geladen ionen ontstaan. De aantrekkingskracht tussen deze ionen houdt de verbinding bij elkaar.
- Covalente bindingen worden gevormd wanneer twee of meer atomen een of meer elektronenparen delen. De gedeelde elektronen worden vastgehouden in een gebied met een hoge elektronendichtheid tussen de kernen van de atomen.
- Metaalverbindingen worden gevormd wanneer de buitenste elektronen van metaalatomen worden gedelokaliseerd, wat betekent dat ze niet met één atoom zijn geassocieerd, maar in plaats daarvan vrij door het hele metaalrooster kunnen bewegen.
Waterstofbruggen zijn een soort intermoleculaire kracht, geen chemische binding. Ze worden gevormd wanneer een waterstofatoom dat covalent gebonden is aan een sterk elektronegatief atoom (zoals stikstof, zuurstof of fluor) interageert met een ander elektronegatief atoom. Deze interactie creëert een dipool-dipool-aantrekkingskracht die de twee moleculen bij elkaar houdt.
Het antwoord is dus waterstofbruggen.
 Welke stof zal, wanneer opgelost in water, een elektrische stroom geleiden?
Welke stof zal, wanneer opgelost in water, een elektrische stroom geleiden?  Sensoren op plantenbladeren waarschuwen voor watertekort
Sensoren op plantenbladeren waarschuwen voor watertekort Wat is de formule voor waterstofjodide?
Wat is de formule voor waterstofjodide?  De elektrische aantrekkingskracht tussen de kernen en valentie-elektronen van verschillende atomen die samenbinden?
De elektrische aantrekkingskracht tussen de kernen en valentie-elektronen van verschillende atomen die samenbinden?  Vloeibare kristalmonomeren die in LCD's worden gebruikt, bleken potentieel persistent en bioaccumulerend te zijn
Vloeibare kristalmonomeren die in LCD's worden gebruikt, bleken potentieel persistent en bioaccumulerend te zijn
 Onderscheidende MJO-activiteit tijdens 2015/2016 super El Nino
Onderscheidende MJO-activiteit tijdens 2015/2016 super El Nino Franse startup Plume probeert luchtkwaliteit te crowdsourcen
Franse startup Plume probeert luchtkwaliteit te crowdsourcen Milieu-effecten van de atoombom
Milieu-effecten van de atoombom  VS moeten opties voor thuiskoeling overwegen tijdens pandemie
VS moeten opties voor thuiskoeling overwegen tijdens pandemie Nieuwe studie vergroot het begrip van hoe de oceaan de Antarctische ijskap doet smelten
Nieuwe studie vergroot het begrip van hoe de oceaan de Antarctische ijskap doet smelten
Hoofdlijnen
- Welke structurele rol spelen fosfolipiden in cellen?
- Verschillende groepen organismen op nummercel?
- Malariaparasiet verpakt genetisch materiaal voor reis van muggen naar mensen
- Ontdekking van virus bij varroamijten geeft hoop op verbetering van overleving van honingbij
- Ecologische niche: definitie, soorten, belang en voorbeelden
- Hoe maak je een 3D-model van de dikke darm
- Hoe gemuteerde zebravissen hielpen het geheim van hun strepen te ontsluiten
- O, snap! Wat de geluidspatronen van krakende garnalen ons kunnen vertellen over rifecosystemen
- Wat doen onze lichaamscellen met zuurstof?
- Partners in katalyse:een efficiënte route naar onverzadigde ketonen
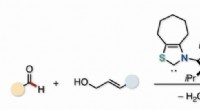
- Wetenschappers ontdekken een betere manier om plastic uit zwavel te maken

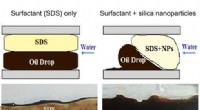
- Nieuwe materialen met belangrijke toepassingen in verbeterde oliewinning
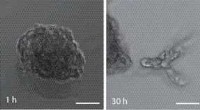
- Microweefsel kweken ter vervanging van dierproeven
- Team neemt het giswerk weg bij het ontdekken van nieuwe legeringen met hoge entropie

 Wat zit er in droogbouwcompound?
Wat zit er in droogbouwcompound?  Hoe maak je een sterke brug uit Popsicle Sticks
Hoe maak je een sterke brug uit Popsicle Sticks Neutronen onderzoeken tomaten voor inzicht in chatter tussen planten
Neutronen onderzoeken tomaten voor inzicht in chatter tussen planten Eetbare insecten kunnen een belangrijk ingrediënt zijn om een wereldwijde voedselcrisis te voorkomen, onderzoekers staan erop:
Eetbare insecten kunnen een belangrijk ingrediënt zijn om een wereldwijde voedselcrisis te voorkomen, onderzoekers staan erop: Waarom stoot Sometime Plane wit gas uit in de lucht?
Waarom stoot Sometime Plane wit gas uit in de lucht?  Wetenschappers onderzoeken de omstandigheden van sterreninterieurs om kernreacties te meten
Wetenschappers onderzoeken de omstandigheden van sterreninterieurs om kernreacties te meten Hoe biobrandstoffen uit plantaardige vezels de opwarming van de aarde kunnen tegengaan
Hoe biobrandstoffen uit plantaardige vezels de opwarming van de aarde kunnen tegengaan  Meer branden en evacuaties in vermoeid Californië
Meer branden en evacuaties in vermoeid Californië
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

