
Wetenschap
Wat is sterker alkalisch loog of natriumcarbonaat?
De sterkte van een alkali wordt bepaald door zijn vermogen om hydroxide-ionen (OH-) aan water te doneren. Hoe meer hydroxide-ionen een alkali kan doneren, hoe sterker deze is.
Natronloog is een zeer oplosbare base die volledig dissocieert in water en natriumionen (Na+) en hydroxide-ionen (OH-) vormt. Het heeft een pH van ongeveer 13, wat duidt op een hoge concentratie hydroxide-ionen.
Aan de andere kant is natriumcarbonaat een matig oplosbaar zout dat een gedeeltelijke dissociatie in water ondergaat. Het vormt natriumionen (Na+) en carbonaationen (CO32-). De carbonaationen kunnen met water reageren om bicarbonaationen (HCO3-) en hydroxide-ionen (OH-) te vormen, maar de concentratie van hydroxide-ionen is lager in vergelijking met natronloog. De pH van een verzadigde natriumcarbonaatoplossing ligt rond de 11.
Daarom wordt natronloog beschouwd als een sterkere alkali dan natriumcarbonaat vanwege de hogere concentratie hydroxide-ionen en het grotere vermogen om de pH van een oplossing te verhogen.
 Miljoenen worstelen zonder stroom terwijl dodelijke koudegolf de VS in zijn greep houdt
Miljoenen worstelen zonder stroom terwijl dodelijke koudegolf de VS in zijn greep houdt EPA werpt zorgen op over de manier waarop Georgië met giftige steenkoolas omgaat
EPA werpt zorgen op over de manier waarop Georgië met giftige steenkoolas omgaat  Beter veenbeheer kan een half miljard ton koolstof besparen
Beter veenbeheer kan een half miljard ton koolstof besparen De haalbaarheid van transformatietrajecten voor het behalen van het Klimaatakkoord van Parijs
De haalbaarheid van transformatietrajecten voor het behalen van het Klimaatakkoord van Parijs Abrupte verschuivingen in het Arctische klimaat verwacht
Abrupte verschuivingen in het Arctische klimaat verwacht
Hoofdlijnen
- COVID-19-medicijnen blijven aanwezig in afvalwater, kunnen een risico vormen voor in het water levende organismen
- Facebook en Apple zijn het er niet over eens hoe ze nepnieuws tijdens de midterms moeten beteugelen
- Hoe doorlatendheid te berekenen
- Welke organellen bevinden zich in een prokaryote cel?
- Sauropod-zwemmers of wandelaars?
- Stamcelplatform werpt nieuw licht op het begin van menselijke ontwikkeling
- Wat zijn de vier voedingsbronnen voor bacteriën?
- Kan rijst water uit landbouwvelden filteren?
- De opkomst van royalty's:hoe arbeiderswespen specialisatie en plasticiteit in evenwicht brengen
- Elektronen zetten één stap vooruit zonder twee stappen terug
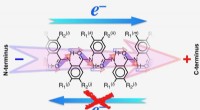
- Ringvormige multi-koolstofverbinding cyclocarbon gesynthetiseerd

- Wetenschappers verkrijgen carbide met hoge entropie in elektrisch boogplasma

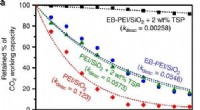
- Onderzoekers produceren 50x stabieler adsorbens
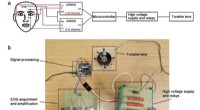
- Ooggestuurde zachte lens maakt de weg vrij voor zachte mens-machine-interfaces
 Retinacellen gekweekt op nanovezelsteigers kunnen blindheid helpen behandelen
Retinacellen gekweekt op nanovezelsteigers kunnen blindheid helpen behandelen  Voorbeelden van Wheel & Axle Simple Machines
Voorbeelden van Wheel & Axle Simple Machines Hoe wolkenkrabbers werken
Hoe wolkenkrabbers werken  Volume en oppervlakte van een soep- en cereicebox zoeken
Volume en oppervlakte van een soep- en cereicebox zoeken Veilig op Mars, InSight ontvouwt zijn arrays en maakt wat foto's
Veilig op Mars, InSight ontvouwt zijn arrays en maakt wat foto's Afgewezen interne sollicitanten twee keer zoveel kans om te stoppen
Afgewezen interne sollicitanten twee keer zoveel kans om te stoppen Herstel van wetlands aan de kust? Controleer de grond
Herstel van wetlands aan de kust? Controleer de grond  Typen Rotor Centrifuges
Typen Rotor Centrifuges
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

