
Wetenschap
Wat zijn Arrhenius-zuren?
Arrheniuszuren zijn stoffen die, wanneer opgelost in water, waterstofionen (H+) vrijgeven.
Volgens de Arrhenius-theorie zijn zuren stoffen die in water dissociëren en H+-ionen produceren. Deze H+-ionen zijn verantwoordelijk voor de zure eigenschappen van de oplossing. Hoe hoger de concentratie H+-ionen in een oplossing, hoe sterker het zuur.
Enkele veel voorkomende voorbeelden van Arrhenius-zuren zijn:
- Zoutzuur (HCl)
- Zwavelzuur (H2SO4)
- Salpeterzuur (HNO3)
- Azijnzuur (CH3COOH)
Arrhenius-zuren zijn doorgaans corrosief en kunnen reageren met metalen om waterstofgas te produceren. Ze kunnen ook reageren met basen om zouten en water te produceren.
 Nieuw materiaal om wonden te behandelen kan beschermen tegen resistente bacteriën
Nieuw materiaal om wonden te behandelen kan beschermen tegen resistente bacteriën Eigenschappen van staalsoorten
Eigenschappen van staalsoorten  De chemische formule voor water is h2o?
De chemische formule voor water is h2o?  Wetenschappers ontwikkelen elastische metalen staven om scoliose te behandelen
Wetenschappers ontwikkelen elastische metalen staven om scoliose te behandelen Wetenschapsprojecten die al zijn voltooid en kunnen worden gekopieerd
Wetenschapsprojecten die al zijn voltooid en kunnen worden gekopieerd
 De hoogte- en dieptepunten van de opiumhandel in zuidelijk Afrika
De hoogte- en dieptepunten van de opiumhandel in zuidelijk Afrika Harde donder van kleine storm in Oregon schudt Portland door elkaar
Harde donder van kleine storm in Oregon schudt Portland door elkaar Wat gebeurt er tijdens fase een van fotosynthese?
Wat gebeurt er tijdens fase een van fotosynthese?  Waarom geven onderzoekers vaak de voorkeur aan veilige boven risicovolle projecten? Risicoaversie in de wetenschap verklaren
Waarom geven onderzoekers vaak de voorkeur aan veilige boven risicovolle projecten? Risicoaversie in de wetenschap verklaren  Diep, slow-slip actie kan de grootste aardbevingen en hun tsunami's leiden
Diep, slow-slip actie kan de grootste aardbevingen en hun tsunami's leiden
Hoofdlijnen
- Robotapparaat volgt plantengroei op cellulair niveau
- Onderzoekers bieden visserij een oplossing voor overbevissing
- Het gebruik van het referentiegenoom van de soort zelf is optimaal voor SNP-aanroepen, zo blijkt uit onderzoek
- Is suiker zuur of onoplosbaar in water?
- Hoe werkt hennep?
- Wat vertoont een eenhuizige plant?
- Netwerken gebruiken om weefselspecifieke genregulatie te begrijpen
- FReD kan helpen verklaren hoe een bij ziet
- Twee soorten fagocyten
- Een doorbraak in katalysatoren:kleiner dan nanoschaal

- Technische defecten in kristallijn materiaal verhogen de elektrische prestaties

- Onderzoekers vinden nieuwe vorm voor hydrofobe moleculen in water

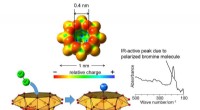
- Polarisatie van broommolecuul in vanadiumoxideclusterholte en nieuwe bromering van alkaan
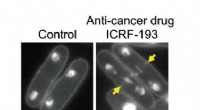
- Antikankermechanisme onthuld in gistexperimenten
 Hoe gigantische tropische fruitvleermuizen te redden:werk samen met lokale jagers die vleermuistanden als geld gebruiken
Hoe gigantische tropische fruitvleermuizen te redden:werk samen met lokale jagers die vleermuistanden als geld gebruiken Voorbeelden van Density-Afhankelijke Beperkende Factoren
Voorbeelden van Density-Afhankelijke Beperkende Factoren Een nieuw kunstmatig kwantummateriaal voor toekomstige computers met hoog rendement
Een nieuw kunstmatig kwantummateriaal voor toekomstige computers met hoog rendement Toyotas 2019 wereldwijde verkoop van voertuigen Volkswagens
Toyotas 2019 wereldwijde verkoop van voertuigen Volkswagens Experimentele tests van relativistische chemie zullen het periodiek systeem bijwerken
Experimentele tests van relativistische chemie zullen het periodiek systeem bijwerken Montana-dam, doorgang om vis te redden heeft geen financiering
Montana-dam, doorgang om vis te redden heeft geen financiering Nieuw materiaal heeft de hoogste elektronenmobiliteit onder bekende gelaagde magnetische materialen
Nieuw materiaal heeft de hoogste elektronenmobiliteit onder bekende gelaagde magnetische materialen Hoe beïnvloedt pH-niveau enzymactiviteit?
Hoe beïnvloedt pH-niveau enzymactiviteit?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

