
Wetenschap
Wat is de Lewis-structuur voor SeF₂?
1. Bepaal het totale aantal valentie-elektronen:
Se:6 valentie-elektronen
2 F:2 x 7 valentie-elektronen =14 valentie-elektronen
Totaal valentie-elektronen =6 + 14 =20 valentie-elektronen
2. Verbind de atomen met enkele bindingen:
Se is het centrale atoom en vormt twee enkele bindingen met twee F-atomen.
3. Verdeel de resterende valentie-elektronen als alleenstaande paren:
Elk F-atoom heeft drie alleenstaande elektronenparen.
Se heeft twee alleenstaande elektronenparen.
4. Controleer de octetregel:
Elk atoom behalve Se heeft een compleet octet aan elektronen. Se heeft 10 elektronen in zijn valentieschil, gezien de alleenstaande paren. Volgens de uitgebreide octetregel voor elementen in de derde periode en daarna is dit acceptabel.
Daarom heeft de Lewis-structuur voor SeF2 een centraal Se-atoom gebonden aan twee F-atomen met twee alleenstaande paren op Se en drie alleenstaande paren op elk F-atoom.
 Ze kunnen meer koolstof vastleggen dan ze uitstoten. Dus waarom zijn houten gebouwen niet mainstream?
Ze kunnen meer koolstof vastleggen dan ze uitstoten. Dus waarom zijn houten gebouwen niet mainstream? Nieuw onderzoek laat zien hoe vleermuizen 's nachts hun weg naar huis 'haasten'
Nieuw onderzoek laat zien hoe vleermuizen 's nachts hun weg naar huis 'haasten'  De utilitaire benadering van het wereldwijde klimaatbeleid verbetert de rechtvaardigheid, milieu en welzijn
De utilitaire benadering van het wereldwijde klimaatbeleid verbetert de rechtvaardigheid, milieu en welzijn Waarom steeds meer koppels ervoor kiezen om apart te gaan wonen
Waarom steeds meer koppels ervoor kiezen om apart te gaan wonen  Hoe binnenwateren koolstof ‘inademen’ – en wat dit betekent voor mondiale systemen
Hoe binnenwateren koolstof ‘inademen’ – en wat dit betekent voor mondiale systemen
Hoofdlijnen
- Hoe een ontevreden wetenschapper wilde bewijzen dat zijn voedsel niet nieuw ontdekte radioactieve tracers was en de Nobelprijs won
- Wat zijn de onderdelen van de celcyclus?
- Studie onderzoekt conflict tussen boeren en roofdieren
- Bacterieel model helpt onthullen hoe ons lichaam bevolkingsexplosies – en kanker – voorkomt
- Een leider in de Amerikaanse zeewierteelt predikt, onderwijst en bouwt een breder netwerk op
- Planten evolueren geuren en kleuren om dieren aan te trekken voor zaadverspreiding
- Onderzoekers gebruiken het ritme van DNA-replicatie om kankercellen te doden
- Welke cel kan een benige matrix opbouwen?
- Wat is Ashwagandha?
- Papavers analyseren om betere medicijnen te maken

- Belangrijke rol van singletzuurstof in synergetisch antimicrobieel mechanisme

- Defect grafeen heeft een hoge elektrokatalytische activiteit
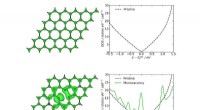
- Een aantal nieuwe stappen leren in de energieconversiedans

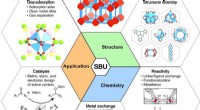
- Secundaire bouweenheden (SBU's) - het keerpunt in de ontwikkeling van metaal-organische raamwerken (MOF's)
 Wetenschappers ontdekken hoe sterrenstelsels kunnen bestaan zonder donkere materie
Wetenschappers ontdekken hoe sterrenstelsels kunnen bestaan zonder donkere materie  Overmatig gebruik van landbouwchemicaliën op kleine boerderijen in China schaadt gezondheid en milieu
Overmatig gebruik van landbouwchemicaliën op kleine boerderijen in China schaadt gezondheid en milieu Groot aantal volwassenen dat niet in staat is om elementaire wiskundige taken uit te voeren
Groot aantal volwassenen dat niet in staat is om elementaire wiskundige taken uit te voeren Bereken Hardcore Hoeveelheden
Bereken Hardcore Hoeveelheden  Activiteiten voor School Family Math Night
Activiteiten voor School Family Math Night  Moleculaire dynamische simulaties onthullen chaos in elektronentransport
Moleculaire dynamische simulaties onthullen chaos in elektronentransport Hoe ontstaat een tsunami na een aardbeving?
Hoe ontstaat een tsunami na een aardbeving?  De kracht van de sterke kracht
De kracht van de sterke kracht
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

