
Wetenschap
Hoe maak je de 1,25 procent H2SO4-oplossing klaar?
1. Bereken de benodigde hoeveelheid geconcentreerd H2SO4
Bepaal het volume geconcentreerd H2SO4 (18,4 M) dat nodig is om 1 liter van de 1,25% H2SO4-oplossing te bereiden.
M1V1 =M2V2,
waarbij M1 en V1 de molariteit en het volume van het geconcentreerde H2SO4 vertegenwoordigen, is M2 de gewenste molariteit (1,25%) en V2 het uiteindelijke volume van de oplossing (1 L).
Als we de formule herschikken om V1 op te lossen, krijgen we:
V1 =(M2 x V2) / M1
De waarden vervangen:
V1 =(0,0125 mol/l x 1 l) / 18,4 mol/l =0,0006842 l of 0,6842 ml
Daarom heeft u ongeveer 0,6842 ml geconcentreerde H2SO4 nodig om 1 liter 1,25% H2SO4-oplossing te bereiden.
2. Bereid de oplossing voor
- Draag geschikte veiligheidsuitrusting, zoals handschoenen en oogbescherming.
- Voeg het berekende volume geconcentreerd H2SO4 (0,6842 ml) langzaam toe aan een klein bekerglas met enkele milliliters gedestilleerd water.
- Draai het bekerglas voorzichtig rond om het zuur en het water te mengen.
- Breng de verdunde zure oplossing over in een maatkolf van 1 liter.
- Spoel het bekerglas met een kleine hoeveelheid gedestilleerd water en breng het spoelwater over naar de maatkolf.
- Voeg meer gedestilleerd water toe aan de kolf totdat de oplossing de 1 L-markering bereikt.
- Meng de oplossing grondig door de kolf rond te draaien.
Uw 1,25% H2SO4-oplossing is nu klaar voor gebruik.
Opmerking: Ga altijd uiterst voorzichtig om met geconcentreerd zwavelzuur, aangezien het een zeer corrosieve stof is. Voeg altijd langzaam zuur aan het water toe, en nooit andersom, om heftige reacties te voorkomen.
 Rise of the mutants:nieuw onderzoek om enzymontwerpmethodologieën te verbeteren
Rise of the mutants:nieuw onderzoek om enzymontwerpmethodologieën te verbeteren Dubbelwerkende katalysator genereert waterstofbrandstof terwijl afvalwater wordt opgeruimd
Dubbelwerkende katalysator genereert waterstofbrandstof terwijl afvalwater wordt opgeruimd Hoe verschilt koolstof 14 van gewone koolstof?
Hoe verschilt koolstof 14 van gewone koolstof?  Wat is een samengesteld gemiddelde in de wetenschap?
Wat is een samengesteld gemiddelde in de wetenschap?  Rode fluorescentie in twee stappen
Rode fluorescentie in twee stappen
 Onderzoek naar gezondheidsrisico's voor kinderen bij twijfel over EPA-fondsen
Onderzoek naar gezondheidsrisico's voor kinderen bij twijfel over EPA-fondsen Studie:Activisme en burgerlijke ongehoorzaamheid helpen de wetenschap van klimaatverandering te communiceren
Studie:Activisme en burgerlijke ongehoorzaamheid helpen de wetenschap van klimaatverandering te communiceren Microben in de bodem zijn essentieel voor het leven en kunnen de klimaatverandering helpen verminderen
Microben in de bodem zijn essentieel voor het leven en kunnen de klimaatverandering helpen verminderen Geïmporteerde ontbossing:hoe Europa wereldwijd bijdraagt aan het verlies van bomen
Geïmporteerde ontbossing:hoe Europa wereldwijd bijdraagt aan het verlies van bomen  Wat zijn drie soorten producenten in het tropische regenwoud?
Wat zijn drie soorten producenten in het tropische regenwoud?
Hoofdlijnen
- Welk belangrijk weefsel bekleedt de lichaamsholte en bedekt het buitenoppervlak?
- Hoe verhoudt het scheppingsverhaal zich tot de celtheorie?
- Ingenieurs ontwikkelen innovatieve softwaretools voor microbioomanalyse
- Zijn dieren nog in ontwikkeling?
- Is uw koffie niet warm of koud? Observeren hoe de hersenen ontkende bijvoeglijke naamwoorden verwerken
- Mechanisme van paarse kleur en smaak van HongShanCaiTai, het keizerlijke gerecht van China, onthuld
- Vechten tegen bubbels:hoe planten zichzelf beschermen tegen dodelijke schimmels
- Hoe werkt een automatische DNA-sequencer?
- Onderzoek laat zien hoe planten de ‘herinnering’ aan een hoog kooldioxidegehalte doorgeven aan hun nakomelingen
- Strategieën om grotere poriën te genereren in metaal-organische raamwerken
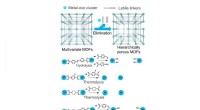
- Nieuwe algoritmen waarvan is aangetoond dat ze het biofarmaceutische proces versnellen

- Onderzoekers ontdekken nieuwe transportroute voor vluchtige plantenstoffen

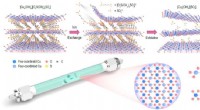
- Ultradun 2D cupraat met actieve periodieke koperen enkele sites, een nieuwe katalysator voor Chan-lam-koppeling
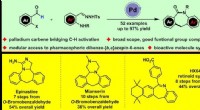
- Modulaire benadering van dibenzo-gefuseerde ε-lactams door middel van carbeen overbruggende CH-activering
 Kevers felle kleuren gebruikt voor camouflage in plaats van roofdieren te waarschuwen
Kevers felle kleuren gebruikt voor camouflage in plaats van roofdieren te waarschuwen Superflare gedetecteerd op een ultrakoele ster
Superflare gedetecteerd op een ultrakoele ster Hoe chimere, druppelvormende eiwitten kunnen bijdragen aan kanker
Hoe chimere, druppelvormende eiwitten kunnen bijdragen aan kanker  Overstromingen in Centraal-Afrikaanse Republiek verlaten minstens 28, 000 daklozen
Overstromingen in Centraal-Afrikaanse Republiek verlaten minstens 28, 000 daklozen Gevaren na natuurbranden:Begrijpen wanneer en hoe een helling kan falen
Gevaren na natuurbranden:Begrijpen wanneer en hoe een helling kan falen  Vrolijk of eng? Het 'Ho ho ho' van de Kerstman weerspiegelt onze eigen dubbelzinnige relatie tot lachen
Vrolijk of eng? Het 'Ho ho ho' van de Kerstman weerspiegelt onze eigen dubbelzinnige relatie tot lachen  Wetenschappers ontwikkelen open-source software om de economie van biobrandstoffen te analyseren, bioproducten
Wetenschappers ontwikkelen open-source software om de economie van biobrandstoffen te analyseren, bioproducten Nieuwe gelamineerde nanostructuur geeft stalen botachtige weerstand tegen breken onder herhaalde belasting
Nieuwe gelamineerde nanostructuur geeft stalen botachtige weerstand tegen breken onder herhaalde belasting
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

