
Wetenschap
Hoe kun je een sterk zuur van een zwak onderscheiden met behulp van een indicator?
Laten we bijvoorbeeld de indicator fenolftaleïne bekijken. Fenolftaleïne is kleurloos in zure oplossingen en wordt roze in basische oplossingen. De overgang vindt plaats bij een pH van ongeveer 8,3.
Als we een paar druppels fenolftaleïne toevoegen aan een oplossing van een sterk zuur, zoals zoutzuur (HCl), blijft de oplossing kleurloos. Dit komt omdat de pH van een sterk zure oplossing doorgaans lager is dan 7, wat lager is dan het overgangspunt van fenolftaleïne.
Aan de andere kant, als we een paar druppels fenolftaleïne toevoegen aan een oplossing van een zwak zuur, zoals azijnzuur (CH3COOH), wordt de oplossing roze. Dit komt omdat de pH van een zwakzure oplossing doorgaans boven de 7 ligt, wat boven het overgangspunt van fenolftaleïne ligt.
Door de kleurverandering van een indicator te observeren, kunnen we daarom onderscheid maken tussen sterke en zwakke zuren. Een sterk zuur zal geen kleurverandering in een indicator veroorzaken, terwijl een zwak zuur ervoor zal zorgen dat de indicator van kleur verandert.
 Op zoek naar sterker staal levert een systematische blik op 120 combinaties van legeringselementen aanwijzingen op
Op zoek naar sterker staal levert een systematische blik op 120 combinaties van legeringselementen aanwijzingen op  Wat is de Vant Hoff-factor voor NaCl als het volledig dissocieert in water?
Wat is de Vant Hoff-factor voor NaCl als het volledig dissocieert in water?  Kooldioxide binden met gebroken beton
Kooldioxide binden met gebroken beton Onderzoek laat zien hoe gas- en temperatuurgecontroleerde bacteriële reacties op Deepwater Horizon-lekken
Onderzoek laat zien hoe gas- en temperatuurgecontroleerde bacteriële reacties op Deepwater Horizon-lekken  Wijn met een dubbele shot vitamine C?
Wijn met een dubbele shot vitamine C?
 Indonesië stopt ontwikkeling nieuwe palmolieplantages
Indonesië stopt ontwikkeling nieuwe palmolieplantages Waarom smolten gashydraten aan het einde van de laatste ijstijd?
Waarom smolten gashydraten aan het einde van de laatste ijstijd? Veroorzaakt koude lucht Latex helium gevulde ballonnen om te laten leeglopen?
Veroorzaakt koude lucht Latex helium gevulde ballonnen om te laten leeglopen?  Welke invloed zal de klimaatverandering hebben op de plek waar hooggelegen alpenvogels leven?
Welke invloed zal de klimaatverandering hebben op de plek waar hooggelegen alpenvogels leven?  Eco-strijders winnen eerste zaak over klimaatverandering in Zuid-Afrika
Eco-strijders winnen eerste zaak over klimaatverandering in Zuid-Afrika
Hoofdlijnen
- Is het een vogel of een dinosaurus? Fossielen uit Teylers Museum in Nederland bezoeken in het geheim de Britse synchrotron
- Hoe een microbiële bioraffinaderij genen reguleert
- Hoe de botten in het menselijk skelet te bestuderen
- Bijenvival:herstelt de bijenpopulatie in Texas zich?
- Ponso helpen, enige overlevende van Chimpansee-eiland in I. Coast
- Hoe een haai te volgen:nieuw onderzoek onthult waar, waarom en hoe haaien en wildvissen elkaar overlappen
- Droogteresistente plantengenen kunnen de evolutie van waterbesparende gewassen versnellen
- Hoe kan het begrijpen van verkeerd gevouwen eiwitten de behandeling van ziekten helpen verbeteren?
- Hoe de ijstijden de evolutie van de vreemde en stugge inheemse planten in Nieuw-Zeeland hebben gestimuleerd
- Chili-vormig apparaat zou kunnen onthullen hoe heet die peper is
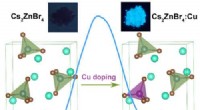
- Methode om blauw-emitterende nuldimensionale volledig anorganische metaalhalogeniden te ontwikkelen
- Kristallen die aardgas zuiveren

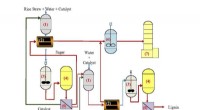
- Onderzoekers zetten twee stappen richting groene brandstof
- Molecuul uit de natuur zorgt voor volledig recyclebare polymeren

 Wiskunde die goed voelt:leermiddelen maken voor blinde leerlingen
Wiskunde die goed voelt:leermiddelen maken voor blinde leerlingen Onderzoekers gebruiken nanoscopische poriën om eiwitstructuur te onderzoeken
Onderzoekers gebruiken nanoscopische poriën om eiwitstructuur te onderzoeken Uit nieuw onderzoek blijkt dat tweederde van de tweedehands geheugenkaarten persoonlijke gegevens van vorige eigenaren bevat
Uit nieuw onderzoek blijkt dat tweederde van de tweedehands geheugenkaarten persoonlijke gegevens van vorige eigenaren bevat Bij onderzoek naar verkeersdoden in New Jersey wordt gekeken hoe dieren in het wild zich wel of niet door de Garden State verplaatsen
Bij onderzoek naar verkeersdoden in New Jersey wordt gekeken hoe dieren in het wild zich wel of niet door de Garden State verplaatsen  Een vijfde fundamentele kracht zou echt kunnen bestaan, maar we hebben het nog niet gevonden
Een vijfde fundamentele kracht zou echt kunnen bestaan, maar we hebben het nog niet gevonden Uit onderzoek blijkt hoe gewervelde dieren de Noordzeebodem vormgeven
Uit onderzoek blijkt hoe gewervelde dieren de Noordzeebodem vormgeven  Worden elektromagnetische golven gekenmerkt door verdunningen en compressies?
Worden elektromagnetische golven gekenmerkt door verdunningen en compressies?  Kunnen kwantumdeeltjes zwaartekrachtgolven nabootsen?
Kunnen kwantumdeeltjes zwaartekrachtgolven nabootsen?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

