
Wetenschap
Hoe beïnvloedt de temperatuur het vat van een reactie?
1. Arrhenius-vergelijking :De Arrhenius-vergelijking beschrijft de relatie tussen temperatuur en de snelheidsconstante (k) van een reactie. Er wordt gesteld dat de snelheidsconstante exponentieel toeneemt naarmate de temperatuur stijgt. Dit betekent dat naarmate de temperatuur stijgt, meer reactantmoleculen voldoende energie hebben om de activeringsenergiebarrière te overwinnen, wat leidt tot een snellere reactiesnelheid.
2. Botsingstheorie :Volgens de botsingstheorie vinden reacties plaats wanneer reactantmoleculen botsen met voldoende energie en de juiste oriëntatie. Hogere temperaturen verhogen de kinetische energie van moleculen, wat resulteert in frequentere en energetische botsingen. Deze verhoogde botsingsfrequentie vergroot de kans op succesvolle botsingen en versnelt daarmee de reactiesnelheid.
3. Activeringsenergie: Activeringsenergie is de minimale energie die nodig is om een reactie te laten plaatsvinden. Het verhogen van de temperatuur levert meer energie aan de reactantmoleculen, waardoor het gemakkelijker voor hen wordt om de activeringsenergie te bereiken en de reactie te ondergaan. Als gevolg hiervan neemt de reactiesnelheid toe bij toenemende temperatuur.
4. Evenwichtsconstante (Keq): De evenwichtsconstante (Keq) vertegenwoordigt de verhouding tussen de concentraties van producten en reactanten bij evenwicht. Temperatuur kan de evenwichtspositie van een reactie beïnvloeden door het evenwicht naar producten of reactanten te verschuiven. Over het algemeen bevoordeelt een temperatuurstijging de producten van een exotherme reactie (geeft warmte vrij) en bevoordeelt de reactanten van een endotherme reactie (absorbeert warmte).
5. Principe van Le Chatelier: Het principe van Le Chatelier stelt dat als er spanning wordt uitgeoefend op een systeem dat zich in evenwicht bevindt, het systeem zal reageren om de spanning tegen te gaan en het evenwicht te herstellen. Temperatuurverandering kan als stress worden beschouwd en het systeem zal zich dienovereenkomstig aanpassen. Als de temperatuur wordt verhoogd, zal het evenwicht verschuiven in de richting waarin warmte wordt verbruikt (endotherme reacties), en als de temperatuur wordt verlaagd, zal het evenwicht verschuiven in de richting waarin warmte vrijkomt (exotherme reacties).
6. Thermodynamica en Gibbs vrije energie (∆G): De Gibbs vrije energieverandering (∆G) bepaalt de spontaniteit en het evenwicht van een reactie. Bij een constante temperatuur en druk zal een reactie spontaan verlopen als ∆G negatief is. Het verhogen van de temperatuur kan de ∆G van een reactie beïnvloeden door de veranderingen in de enthalpie (∆H) en entropie (∆S) te veranderen. Afhankelijk van de specifieke waarden van ∆H en ∆S kunnen temperatuurveranderingen het evenwicht verschuiven naar producten of reactanten.
Samenvattend speelt temperatuur een cruciale rol in de kinetiek en het evenwicht van chemische reacties. Het beïnvloedt de reactiesnelheid door de activeringsenergie en de botsingsfrequentie te beïnvloeden. Temperatuur kan ook de evenwichtspositie van een reactie verschuiven volgens de principes van de thermodynamica en het principe van Le Chatelier. Het begrijpen van de temperatuurafhankelijkheid van reacties is essentieel voor het optimaliseren en beheersen van chemische processen.
 Onderzoekers berekenen hoe riviernetwerken zich door een landschap bewegen
Onderzoekers berekenen hoe riviernetwerken zich door een landschap bewegen  Wetenschap onderwijzen aan religieuzen? Focus op hoe theorieën zich ontwikkelen
Wetenschap onderwijzen aan religieuzen? Focus op hoe theorieën zich ontwikkelen  Druk niet op de knop van onomkeerbare verandering:top klimaatwetenschapper
Druk niet op de knop van onomkeerbare verandering:top klimaatwetenschapper Door klimaatverandering lopen honderden luchthavens aan de kust het risico op overstromingen
Door klimaatverandering lopen honderden luchthavens aan de kust het risico op overstromingen Hoe een boorschip kernen trekt van 2,5 mijl onder de zee
Hoe een boorschip kernen trekt van 2,5 mijl onder de zee
Hoofdlijnen
- Kunnen visvijvers helpen bij de voedselduurzaamheid van Hawaï?
- De 3 soorten bacteriën
- Moleculaire simulaties verklaren hoe enzymatische pompen calciumionen in spiercellen transporteren
- Je bent niet wat je eet
- Citroenfruit versterken om beter bestand te zijn tegen klimaatverandering
- Noem de reatanten en producten van fotosynthese-ademhaling?
- Kun je evolueren terwijl je robuust bent?
- Wat is de structuur van stamcellen?
- Bij exocytose versmelt het membraanpakket met?
- Perovskietmaterialen:Neutronen tonen twinning in halide perovskieten

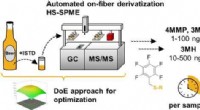
- Fruitige thiolen opsnuiven in hoppige bieren
- Spannende nieuwe ontwikkelingen voor polymeren gemaakt van afvalzwavel

- Onderzoekers maken complexe molecule die spontaan vouwt als een eiwit
- Een manier om polystyreen te recyclen tot waardevollere producten

 Fysica van tumoren:kankercellen worden gefluïdiseerd en persen door weefsel
Fysica van tumoren:kankercellen worden gefluïdiseerd en persen door weefsel Behandeling van ‘back-to-school’-oorinfecties zonder antibioticaresistentie
Behandeling van ‘back-to-school’-oorinfecties zonder antibioticaresistentie  Aardworm Phylum Kenmerken
Aardworm Phylum Kenmerken Waarom een groot deel van Noordoost-Amerika te maken krijgt met 'sneeuwdroogte'
Waarom een groot deel van Noordoost-Amerika te maken krijgt met 'sneeuwdroogte'  Oostenrijk stelt voor om internetgiganten 5 procent van de advertentie-inkomsten te belasten
Oostenrijk stelt voor om internetgiganten 5 procent van de advertentie-inkomsten te belasten Nieuwe film toont Cassinis eerste duik boven Saturnus
Nieuwe film toont Cassinis eerste duik boven Saturnus Economische impact van COVID-19 zal de strijd tegen klimaatverandering moeilijker maken
Economische impact van COVID-19 zal de strijd tegen klimaatverandering moeilijker maken Zeldzaam eerste moment van stellaire explosie vastgelegd door amateurastronoom
Zeldzaam eerste moment van stellaire explosie vastgelegd door amateurastronoom
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

