
Wetenschap
Waarom geleiden ionische verbindingen opgelost in water een elektrische stroom?
Ionische verbindingen opgelost in water geleiden een elektrische stroom vanwege de aanwezigheid van vrij bewegende ionen in de oplossing. Wanneer een ionische verbinding, zoals natriumchloride (NaCl), wordt opgelost in water, dissocieert de verbinding in de samenstellende ionen - natrium- (Na+) en chloride- (Cl-) -ionen - een proces dat bekend staat als ionisatie. Deze ionen worden opgelost door watermoleculen en omringen zichzelf met watermoleculen, waardoor de elektrostatische aantrekking tussen ionen wordt verminderd.
Wanneer er een elektrische stroom door de oplossing wordt geleid, kunnen deze gesolvateerde ionen vrij naar de tegengesteld geladen elektroden bewegen. De positief geladen natriumionen (kationen) bewegen naar de kathode (negatieve elektrode), terwijl de negatief geladen chloride-ionen (anionen) naar de anode (positieve elektrode) bewegen. Deze beweging van ionen vormt een elektrische stroom die door de oplossing vloeit.
Daarom zorgt de aanwezigheid van vrij bewegende ionen in de oplossing ervoor dat ionische verbindingen opgelost in water een elektrische stroom kunnen geleiden.
 Plastic-etende enzymcocktail luidt nieuwe hoop in voor plastic afval
Plastic-etende enzymcocktail luidt nieuwe hoop in voor plastic afval Is de reactie van koper en zuur een chemische of fysische verandering?
Is de reactie van koper en zuur een chemische of fysische verandering?  4-D bio-engineering materialen buigen, kromming als natuurlijk weefsel
4-D bio-engineering materialen buigen, kromming als natuurlijk weefsel Ingenieurs bedenken nieuwe methode om schadelijke E. coli uit water te verwijderen
Ingenieurs bedenken nieuwe methode om schadelijke E. coli uit water te verwijderen Buisjes om celgroei te stoppen
Buisjes om celgroei te stoppen
 Vroeg begin van de afname van het arctische zee-ijs in de 20e eeuw
Vroeg begin van de afname van het arctische zee-ijs in de 20e eeuw Nu de planeet wordt geconfronteerd met een polycrisis, ontdekken biodiversiteitsonderzoekers grote kennislacunes
Nu de planeet wordt geconfronteerd met een polycrisis, ontdekken biodiversiteitsonderzoekers grote kennislacunes  Nieuw VN-rapport onthult onthutsende menselijke klimaatvoetafdruk op water en ijs
Nieuw VN-rapport onthult onthutsende menselijke klimaatvoetafdruk op water en ijs Nieuwe factor in de koolstofcyclus van de Zuidelijke Oceaan geïdentificeerd
Nieuwe factor in de koolstofcyclus van de Zuidelijke Oceaan geïdentificeerd Oceaanstromingen dreigen de Antarctische ijsplaten te laten instorten, zo blijkt uit onderzoek
Oceaanstromingen dreigen de Antarctische ijsplaten te laten instorten, zo blijkt uit onderzoek
Hoofdlijnen
- Onderzoek onderzoekt hoe druivenplagen bessen opsnuiven
- Waarom hitte gebruiken om de microbiële groei onder controle te houden?
- Biologen onderzoeken waarom de zoete smaak van suikerhoudend voedsel afneemt als het gekoeld is
- Wat doodde de dinosaurussen?
- Onderzoekers tonen aan dat generalistische soorten ‘manusje-van-alles zijn en alles beheersen’
- Uitvindingen van de evolutie:wat kikkers een gezicht geeft
- De centrale hoek vinden
- Australië vermeldt kleine wallaby onder nieuwe bedreigde diersoorten
- Facebook-regels in één oogopslag:wat is er precies verboden?
- Chemici gebruiken lichtenergie om kleine moleculaire ringen te produceren
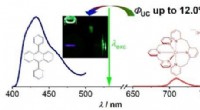
- Een nieuw pad voor duurzame opconversie van fotonen met niet-edele metalen
- Waterdraden kunnen een grotere rol spelen in de cellulaire functie

- Chirurgisch materiaal op basis van eierschalen voor schedelverwondingen
- Een superatoom synthetiseren:deuren openen voor hun gebruik als vervanging voor elementaire atomen

 De rol van enzymen in chemische reacties
De rol van enzymen in chemische reacties Ruimtetoerisme zou wetenschappelijk en gezondheidsonderzoek een boost kunnen geven - hier hoe?
Ruimtetoerisme zou wetenschappelijk en gezondheidsonderzoek een boost kunnen geven - hier hoe? Drie nieuwe gasreuzen exoplaneten ontdekt door SuperWASP-Zuid
Drie nieuwe gasreuzen exoplaneten ontdekt door SuperWASP-Zuid Nieuwe verzameling kaarten en datascapes die de ruimtelijke gevolgen van klimaatverandering vastleggen
Nieuwe verzameling kaarten en datascapes die de ruimtelijke gevolgen van klimaatverandering vastleggen Genderdiscriminatie bedreigt gewasopbrengst bij kleine boeren in Afrika, onderzoekers zeggen:
Genderdiscriminatie bedreigt gewasopbrengst bij kleine boeren in Afrika, onderzoekers zeggen: Een derde van de wereldwijde landbouwgrond met een hoog risico op vervuiling door pesticiden
Een derde van de wereldwijde landbouwgrond met een hoog risico op vervuiling door pesticiden Uit onderzoek blijkt dat Beluga-walvissen veranderen wat ze eten als gevolg van de klimaatverandering
Uit onderzoek blijkt dat Beluga-walvissen veranderen wat ze eten als gevolg van de klimaatverandering  Het haringgenoom biedt nieuw inzicht in hoe soorten zich aanpassen aan hun omgeving
Het haringgenoom biedt nieuw inzicht in hoe soorten zich aanpassen aan hun omgeving
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

