
Wetenschap
Hoe verhoudt het smeltpunt zich tussen moleculaire verbindingen en ionische verbindingen?
Moleculaire verbindingen:
- Moleculaire verbindingen zijn samengesteld uit moleculen die bij elkaar worden gehouden door intermoleculaire krachten, zoals van der Waals-krachten, dipool-dipoolinteracties of waterstofbruggen.
- Intermoleculaire krachten zijn over het algemeen zwakker dan de ionische bindingen in ionische verbindingen.
- Zwakkere krachten vereisen minder energie om te overwinnen, wat resulteert in lagere smeltpunten voor moleculaire verbindingen.
Ionische verbindingen:
- Ionische verbindingen bestaan uit positief geladen ionen (kationen) en negatief geladen ionen (anionen) die bij elkaar worden gehouden door sterke elektrostatische krachten die ionische bindingen worden genoemd.
- Ionische bindingen zijn aanzienlijk sterker dan intermoleculaire krachten.
- De sterke aantrekkingskrachten tussen tegengesteld geladen ionen in ionische verbindingen vereisen meer energie om te breken, wat leidt tot hogere smeltpunten.
Als algemene trend hebben moleculaire verbindingen de neiging smeltpunten te hebben die variëren van lage tot gematigde temperaturen, terwijl ionische verbindingen doorgaans hogere smeltpunten vertonen. Hier zijn enkele voorbeelden:
Moleculaire verbindingen:
- Methaan (CH4):-182,5°C
- Ethanol (CH3CH2OH):-114,1°C
- Sucrose (C12H22O11):186°C
Ionische verbindingen:
- Natriumchloride (NaCl):801°C
- Calciumoxide (CaO):2.613°C
- IJzer(III)oxide (Fe2O3):1.566°C
Het concept van smeltpuntvergelijking tussen moleculaire en ionische verbindingen is ook van toepassing op andere categorieën verbindingen, zoals vaste stoffen uit covalente netwerken en metaalverbindingen. Covalente vaste stoffen uit het netwerk, zoals diamant, hebben extreem sterke covalente bindingen en uitzonderlijk hoge smeltpunten. Metaalverbindingen, gekenmerkt door metaalbinding, hebben over het algemeen tussenliggende smeltpunten vergeleken met moleculaire en ionische verbindingen.
 Gevoed door wind, grootste wildvuur beweegt in de buurt van de stad Californië
Gevoed door wind, grootste wildvuur beweegt in de buurt van de stad Californië Onderzoek:Zwitserse gletsjers zijn al gehalveerd en smelten sneller
Onderzoek:Zwitserse gletsjers zijn al gehalveerd en smelten sneller Rapport:Meststof, mest top Lake Erie fosforbronnen
Rapport:Meststof, mest top Lake Erie fosforbronnen Veel aanrijdingen tussen dieren en voertuigen te voorkomen
Veel aanrijdingen tussen dieren en voertuigen te voorkomen Hoe beleid tegen wildgroei de waterkwaliteit kan schaden
Hoe beleid tegen wildgroei de waterkwaliteit kan schaden
Hoofdlijnen
- Overeenkomsten in de structuur van mitochondria en chloroplasten
- Welke dieren zijn het beste bestand tegen klimaatverandering?
- Hoe planten hun suikertransportroutes vormen
- Critici slaan VS over import van olifantentrofeeën
- Nieuw geïdentificeerde genen kunnen gewassen helpen beschermen tegen overstromingen
- Waar komt al het goud vandaan?
- Waarom malariaparasieten sneller zijn dan menselijke immuuncellen
- Wat is landbouwbiotechnologie? | Hoe dingen werken
- Wat denkt jouw hond? Hersenscans onthullen hondengeheimen in Emory-onderzoek
- Machine learning verbindt materiaalsamenstelling en prestaties in katalysatoren
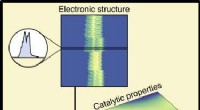
- Onderzoekers onthullen op oxygenaat gebaseerde routes bij de omzetting van syngas via bifunctionele oxide-zeolietkatalysatoren

- NIST-ontdekking zou de nauwkeurigheid kunnen vergroten bij het meten van de bloedstroom voor kankerdiagnose, andere toepassingen
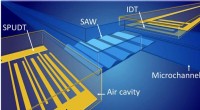
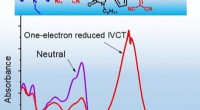
- Ingeschakelde IR-actieve organische pigmenten
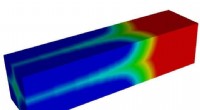
- Studie onthult onbekende details over veelgebruikte lithium-ionbatterijmaterialen
 Hoe bosbranden werken
Hoe bosbranden werken  Klimaatverandering en bosbranden - hoe weten we of er een verband is?
Klimaatverandering en bosbranden - hoe weten we of er een verband is? Jura-dinosaurus met vogelschild was een van de eersten die in kuddes leefde
Jura-dinosaurus met vogelschild was een van de eersten die in kuddes leefde De persoonlijkheid van vluchtelingen is een van de factoren die bepalen hoe succesvol integratie is
De persoonlijkheid van vluchtelingen is een van de factoren die bepalen hoe succesvol integratie is  Cathay zegt dat de meest intense periode van datalek maanden duurde
Cathay zegt dat de meest intense periode van datalek maanden duurde Chinese autofabrikanten tonen goederen in Genève als verkooptank aan huis
Chinese autofabrikanten tonen goederen in Genève als verkooptank aan huis  Doorbraaktool voorspelt eigenschappen van theoretische materialen
Doorbraaktool voorspelt eigenschappen van theoretische materialen De revolutionaire technologieën die de Parker Solar Probe van stroom voorzien en koelen
De revolutionaire technologieën die de Parker Solar Probe van stroom voorzien en koelen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

