
Wetenschap
Is er een verband tussen de positie van een element in het periodiek systeem en de chemische reactiviteit ervan?
Hier ziet u hoe de positie van een element in het periodiek systeem de chemische reactiviteit ervan beïnvloedt:
1. Groepen (verticale kolommen):
- Elementen in dezelfde groep hebben hetzelfde aantal valentie-elektronen.
- Valentie-elektronen zijn de elektronen in de buitenste schil van een atoom en zijn verantwoordelijk voor chemische reacties.
- Naarmate je een groep lager gaat, neemt het aantal elektronenschillen toe, maar het aantal valentie-elektronen blijft hetzelfde.
- Dit leidt tot een afname van de ionisatie-energie en elektronegativiteit van de elementen naarmate je in een groep naar beneden gaat.
2. Punten (horizontale rijen):
- Elementen in dezelfde periode hebben hetzelfde aantal elektronenschillen.
- Naarmate je over een periode van links naar rechts beweegt, neemt het aantal valentie-elektronen toe.
- Dit resulteert in een toename van de ionisatie-energie en elektronegativiteit over een bepaalde periode.
Over het algemeen geldt dat hoe meer valentie-elektronen een element heeft, hoe reactiever het is. Dit komt omdat elementen met meer valentie-elektronen gemakkelijk elektronen kunnen verliezen of winnen om een stabiele configuratie te bereiken.
Hier zijn enkele specifieke voorbeelden van hoe de positie van een element in het periodiek systeem de reactiviteit ervan beïnvloedt:
- Groep 1 (Alkalimetalen): Deze elementen hebben één valentie-elektron en zijn zeer reactief. Ze verliezen gemakkelijk hun valentie-elektron om positieve ionen te vormen en reageren krachtig met water om hydroxiden en waterstofgas te produceren.
- Groep 17 (Halogenen): Deze elementen hebben zeven valentie-elektronen en zijn ook zeer reactief. Ze krijgen gemakkelijk één elektron om hun buitenste schil te voltooien en negatieve ionen te vormen. Halogenen reageren met veel elementen om zouten te vormen.
- Overgangsmetalen: Deze elementen hebben gedeeltelijk gevulde d-orbitalen en kunnen variabele oxidatietoestanden vertonen. Ze zijn over het algemeen minder reactief dan alkalimetalen en halogenen, maar vertonen nog steeds een breed scala aan chemisch gedrag.
Het periodiek systeem biedt waardevolle inzichten in de chemische reactiviteit van elementen op basis van hun positie en elektronische configuraties. Hiermee kunnen scheikundigen het gedrag van elementen voorspellen en materialen met specifieke eigenschappen ontwerpen.
 Wetenschappers vergelijken bodemmicroben in no-till, conventionele grondbewerkingssystemen van boerderijen in de Pacific Northwest
Wetenschappers vergelijken bodemmicroben in no-till, conventionele grondbewerkingssystemen van boerderijen in de Pacific Northwest Wat gebeurt er met de Arctische en subarctische meren in het laagseizoen?
Wat gebeurt er met de Arctische en subarctische meren in het laagseizoen? Eerste bewijs dat de ijsplaten op Antarctica dunner worden en ervoor zorgen dat er meer ijs van het land naar de zee gaat
Eerste bewijs dat de ijsplaten op Antarctica dunner worden en ervoor zorgen dat er meer ijs van het land naar de zee gaat Informatie over een bosecosysteem
Informatie over een bosecosysteem  Hoe wetenschappers en gemeenschappen partnerschappen kunnen opbouwen om overstromingen het hoofd te bieden:leren van Indonesië
Hoe wetenschappers en gemeenschappen partnerschappen kunnen opbouwen om overstromingen het hoofd te bieden:leren van Indonesië
Hoofdlijnen
- wat zijn de bestanddelen van voedsel?
- Tussen geometrie en biologie:hoe waarom is het aantal soorten afhankelijk van het gebied?
- T. rex geen stand-upman? Test je dinovaardigheden (Update)
- Australië vermeldt kleine wallaby onder nieuwe bedreigde diersoorten
- De cel wegen:voor het eerst meten hoe afzonderlijke cellen massa accumuleren (met video)
- Wetenschappers onthullen hoe fosfaat ontsnapt uit actinefilamenten
- Welke processen brengen materiaal naar de cellen?
- Hoe is de katoenplant aangepast om te overleven?
- Wetenschapsprojecten: roken en de effecten ervan op de longen
- Een eenstaps multikatalytische methode om racemische mengsels te verrijken tot een enkele enantiomeer
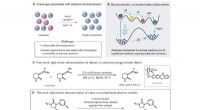
- Ontwikkelen van geleidende en elektrokatalytische mediatoren in Li-S-batterijen

- Uitvinding aangewakkerd door COVID-19-pandemie desinfecteert continu veilig oppervlakken

- Wetenschappers isoleren kankerstamcellen met behulp van nieuwe methode

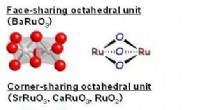
- Bariumruthenaat:een hoog rendement, gemakkelijk te hanteren perovskietkatalysator voor de oxidatie van sulfiden
 Een aap en een virus:een miljoen jaar samen
Een aap en een virus:een miljoen jaar samen Enkele atomen als katalysator
Enkele atomen als katalysator Inflexibeler dan gedacht
Inflexibeler dan gedacht Plastic fantastische of op de natuur gebaseerde speeltuinen:wat is het beste voor de ontwikkeling van kinderen?
Plastic fantastische of op de natuur gebaseerde speeltuinen:wat is het beste voor de ontwikkeling van kinderen?  Een spanningsstabilisator aansluiten
Een spanningsstabilisator aansluiten  Nieuw onderzoek onthult waarom oudere Australiërs terugdeinzen om selfies te maken
Nieuw onderzoek onthult waarom oudere Australiërs terugdeinzen om selfies te maken Nieuwe grens voor 3D-printen ontwikkelt ultramoderne zachte materialen die zichzelf kunnen herstellen
Nieuwe grens voor 3D-printen ontwikkelt ultramoderne zachte materialen die zichzelf kunnen herstellen IJzer is overal in de buurt van de aarde, suggereren twee decennia aan clustergegevens
IJzer is overal in de buurt van de aarde, suggereren twee decennia aan clustergegevens
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

