
Wetenschap
Wanneer een stof een toestandsverandering ondergaat, is de temperatuur pas voltooid?
Tijdens een faseovergang wordt energie door de stof geabsorbeerd of vrijgegeven om de toestand ervan te veranderen, maar de temperatuur blijft constant. Wanneer ijs bijvoorbeeld smelt, absorbeert het energie uit de omgeving, maar de temperatuur blijft op 0°C totdat al het ijs is gesmolten. Op dezelfde manier absorbeert water, wanneer het kookt, energie en blijft de temperatuur op 100°C totdat al het water is verdampt.
De energie die nodig is voor een faseovergang wordt de latente warmte genoemd. Latente warmte is de hoeveelheid energie die nodig is om de toestand van een stof te veranderen zonder de temperatuur ervan te veranderen. De latente smeltwarmte is de energie die nodig is om een vaste stof te smelten, terwijl de latente verdampingswarmte de energie is die nodig is om een vloeistof te verdampen.
Faseovergangen zijn belangrijk bij veel natuurlijke processen, zoals het smelten van ijs, het koken van water en de condensatie van wolken. Ze worden ook gebruikt in industriële processen, zoals de raffinage van metalen en de productie van kunststoffen.
 Nieuw onderzoek toont aan dat hoge en oudere Amazonebossen beter bestand zijn tegen droogte
Nieuw onderzoek toont aan dat hoge en oudere Amazonebossen beter bestand zijn tegen droogte Vroege COVID-19-lockdowns hadden minder impact op de stedelijke luchtkwaliteit dan eerst werd gedacht
Vroege COVID-19-lockdowns hadden minder impact op de stedelijke luchtkwaliteit dan eerst werd gedacht Octopus
Octopus Droogte:waarom sommige bomen in het VK in augustus hun bladeren verliezen
Droogte:waarom sommige bomen in het VK in augustus hun bladeren verliezen Hoe warm weer of felle lichten de groengroei van bomen kunnen beïnvloeden
Hoe warm weer of felle lichten de groengroei van bomen kunnen beïnvloeden
Hoofdlijnen
- Team onderzoekt hoe egoïstische genen mannelijke onvruchtbaarheid veroorzaken bij bloeiende planten
- Welke structuren worden aangetroffen in dierlijke cellen, maar niet in plantencellen?
- Hoe Venus Flytraps werken
- Epigenetische inzichten:hoe hybride populier scheuten regenereert
- Hoe de overgang naar landbouw de huidige bevolking beïnvloedt
- Ontsnappingsartiesten:hoe vibriobacteriën uit cellen breken
- De genetische blauwdruk van woestijnpopulieren:inzichten in aanpassings- en overlevingsmechanismen
- Hoe bloedvlekpatroonanalyse werkt
- Wat is neutrofilis?
- Ingenieurs hergebruiken 19e-eeuwse fotografietechniek om rekbare, van kleur veranderende films te maken

- Op de natuur geïnspireerde antibacteriële metalen

- Platinavrije katalysatoren kunnen goedkopere waterstofbrandstofcellen maken

- Marcus-regime in organische apparaten - grensvlakladingsoverdrachtsmechanisme geverifieerd
- Moleculen uit moedermelk en zeewier suggereren strategieën voor het beheersen van norovirus
 Wat is het verschil tussen een Centriole en een Centrosome?
Wat is het verschil tussen een Centriole en een Centrosome?  Astronomen ontdekken hoe langlevende Peter Pan-schijven evolueren
Astronomen ontdekken hoe langlevende Peter Pan-schijven evolueren  Welke chemische verbindingen worden geacht verantwoordelijk te zijn voor de smaken van bitter, zuur, zout en zoet
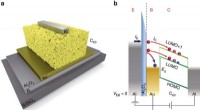
Welke chemische verbindingen worden geacht verantwoordelijk te zijn voor de smaken van bitter, zuur, zout en zoet  Baanbrekende technologie die verder gaat dan silicium via residuvrije veldeffecttransistors
Baanbrekende technologie die verder gaat dan silicium via residuvrije veldeffecttransistors  Is ammoniumhydroxide een moleculaire verbinding?
Is ammoniumhydroxide een moleculaire verbinding?  Ruimtestation markeert 20 jaar mensen die in een baan om de aarde leven
Ruimtestation markeert 20 jaar mensen die in een baan om de aarde leven Bedreigde migrerende adelaars getroffen door de oorlog in Oekraïne, blijkt uit nieuw onderzoek
Bedreigde migrerende adelaars getroffen door de oorlog in Oekraïne, blijkt uit nieuw onderzoek  Australische politie jaagt op moordenaar van gigantische krokodil
Australische politie jaagt op moordenaar van gigantische krokodil
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

