
Wetenschap
Wat gebeurt er met de reactiesnelheid als deze opraakt?
De relatie tussen de reactiesnelheid en de concentratie van een reactant kan worden beschreven met de volgende vergelijking:
```
tarief =k[A]^x[B]^y
```
In deze vergelijking is de snelheid de snelheid van de reactie, k is de snelheidsconstante, [A] en [B] zijn de concentraties van de reactanten A en B, en x en y zijn de orden van de reactie met betrekking tot A. en B, respectievelijk.
Naarmate de concentratie van een reactant afneemt, neemt de overeenkomstige term in de snelheidsvergelijking af. Dit zorgt ervoor dat de totale reactiesnelheid afneemt.
De snelheid van een reactie kan ook worden beïnvloed door andere factoren, zoals temperatuur, druk en de aanwezigheid van een katalysator. De afname van de reactiesnelheid naarmate een reactant opgebruikt is, is echter een algemeen principe dat van toepassing is op de meeste chemische reacties.
 Nieuwe theorie laat zien hoe spanning zorgt voor betere katalysatoren
Nieuwe theorie laat zien hoe spanning zorgt voor betere katalysatoren Wetenschappers creëren een methode om hydrogels en andere polymere materialen te binden met behulp van chitosan
Wetenschappers creëren een methode om hydrogels en andere polymere materialen te binden met behulp van chitosan  Wat voor soort reactie wordt hier weergegeven 4P 5O2 2P2O5?
Wat voor soort reactie wordt hier weergegeven 4P 5O2 2P2O5?  Welke eigenschappen hebben arseen en germaniumsilicium gemeen?
Welke eigenschappen hebben arseen en germaniumsilicium gemeen?  Over Bleach Neutralizers
Over Bleach Neutralizers
 Indringende vraag:Zijn wateroorlogen in onze toekomst?
Indringende vraag:Zijn wateroorlogen in onze toekomst?  Diepzeesedimenten onthullen chaos in het zonnestelsel:een vooruitgang in het dateren van geologische archieven
Diepzeesedimenten onthullen chaos in het zonnestelsel:een vooruitgang in het dateren van geologische archieven Geen bodem achtergelaten:hoe een kosteneffectieve technologie arme velden kan verrijken
Geen bodem achtergelaten:hoe een kosteneffectieve technologie arme velden kan verrijken Wetenschappers demonstreren met hoge resolutie dat lidar de geboortezone van wolkendruppeltjes ziet, een allereerste observatie op afstand
Wetenschappers demonstreren met hoge resolutie dat lidar de geboortezone van wolkendruppeltjes ziet, een allereerste observatie op afstand  Klimaatverandering, ongedierte, omgevallen bomen een dodelijk recept voor Amerikaanse bossen
Klimaatverandering, ongedierte, omgevallen bomen een dodelijk recept voor Amerikaanse bossen
Hoofdlijnen
- Wat is de relatie tussen een chromosoom en een allel?
- Hoe hunkering naar voedsel
- Op de maat blijven is gekoppeld aan reproductief succes bij mannelijke rotsklipdassen
- Haaienaanvallen nemen wereldwijd toe, zegt onderzoek:hoe vaak komen ze voor in Californië?
- Een 140 jaar oud monster van de Tassie-tijgerhersenen overleefde twee wereldoorlogen en bereikte ons laboratorium. Dit is wat we hebben gevonden
- Waarom is er een oneindige variatie mogelijk in eiwitten?
- Indringende vraag:Wat doodt de honingbijen?
- Uit onderzoek blijkt dat het opnieuw verwilderen van grote dieren de achteruitgang van het ecosysteem kan verzachten
- Onderzoekers identificeren afweermechanisme van malariaparasiet
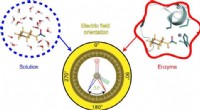
- Elektrische velden in kaart brengen om te helpen ontrafelen hoe enzymen werken
- Wetenschappers hebben nieuwe verbindingen ontdekt met herbicide potentieel van zeeschimmel

- Knipper en je zult amyloïden niet missen

- Een theoretische studie verklaart de natuurlijke selectie van eiwitten
- Versnelde ontdekkingssnelheid kan leiden tot effectievere hulpmiddelen om te stoppen met roken
 Nanodeeltjes kunnen een gemakkelijkere route bieden voor celtherapie
Nanodeeltjes kunnen een gemakkelijkere route bieden voor celtherapie Het ademhalingssysteem van een vlinder
Het ademhalingssysteem van een vlinder  Zonnewind rond Pluto-instrument bevestigt dat zonnewind verder van de zon af vertraagt
Zonnewind rond Pluto-instrument bevestigt dat zonnewind verder van de zon af vertraagt Gezondere zuivelproducten met bacteriële films en nanovezelmembranen
Gezondere zuivelproducten met bacteriële films en nanovezelmembranen 5, 000 Dieselgate-sterfgevallen in Europa per jaar:studie
5, 000 Dieselgate-sterfgevallen in Europa per jaar:studie Wie zijn de immigranten die om humanitaire redenen naar de VS komen, en hoe kunnen zij worden ondersteund?
Wie zijn de immigranten die om humanitaire redenen naar de VS komen, en hoe kunnen zij worden ondersteund?  Wetenschapsprojecten: Hoe voorkom je dat ijs smelt
Wetenschapsprojecten: Hoe voorkom je dat ijs smelt  Kunnen wespen de Britse conkerbomen helpen redden?
Kunnen wespen de Britse conkerbomen helpen redden?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

