
Wetenschap
Hoeveel gram zuurstof is nodig om te reageren met 23,9 ammoniak?
$$4NH_3 + 5O_2 \pijl naar rechts 4NO + 6H_2O$$
Vervolgens berekenen we het aantal mol ammoniak met behulp van de molaire massa:
$$Moles\ van\ NH_3 =\frac{23,9\ g}{17,04\ g/mol} =1,404\ mol$$
Volgens de uitgebalanceerde chemische vergelijking reageert 4 mol ammoniak met 5 mol zuurstof. Daarom kunnen we het benodigde aantal mol zuurstof berekenen:
$$Moles\ van\ O_2 =1,404\ mol\ NH_3 \times \frac{5\ mol\ O_2}{4\ mol\ NH_3} =1,755\ mol\ O_2$$
Ten slotte converteren we het aantal mol zuurstof terug naar grammen met behulp van de molaire massa:
$$Gram\ van\ O_2 =1,755\ mol \maal 32,00\ g/mol =56,32\ g$$
Er is dus 56,32 gram zuurstof nodig om te reageren met 23,9 gram ammoniak.
 Nf3 heeft drie f-atomen gebonden aan een centraal n-atoom met één eenzaam elektronenpaar op de vorm van het molecuul?
Nf3 heeft drie f-atomen gebonden aan een centraal n-atoom met één eenzaam elektronenpaar op de vorm van het molecuul?  De onzichtbare katalysator die chemische reacties kan stimuleren
De onzichtbare katalysator die chemische reacties kan stimuleren Hoe wordt de protongradiënt vastgesteld?
Hoe wordt de protongradiënt vastgesteld?  Onderzoekers vinden een manier om het hele spectrum van zonlicht te benutten
Onderzoekers vinden een manier om het hele spectrum van zonlicht te benutten Wat is de vergelijking van de fotosynthese?
Wat is de vergelijking van de fotosynthese?
 Klimigratie:wanneer gemeenschappen moeten verhuizen vanwege klimaatverandering
Klimigratie:wanneer gemeenschappen moeten verhuizen vanwege klimaatverandering New Orleans onder avondklok omdat het zuiden van de VS overeenkomt met de schade door orkaan Ida
New Orleans onder avondklok omdat het zuiden van de VS overeenkomt met de schade door orkaan Ida Opwarming om onweersbuien groter en frequenter te maken (update)
Opwarming om onweersbuien groter en frequenter te maken (update) Wat hebben slakken nodig om te leven?
Wat hebben slakken nodig om te leven?  Wat zijn de aanpassingen voor reptielen om te leven op het land?
Wat zijn de aanpassingen voor reptielen om te leven op het land?
Hoofdlijnen
- Soorten Agar-platen
- Sommige dieren pauzeren hun eigen zwangerschappen, maar hoe ze dat doen is nog steeds een mysterie
- Skelet van enorme dinosaurus opgegraven in Portugal
- Indringende vraag:Wat doodt de honingbijen?
- Nieuwe genetische variatie van oude en exotische variëteiten voor milieuvriendelijke tarweteelt
- 7 soorten bindweefsel
- Appelbomen dragen meer fruit als ze omringd zijn door goede buren
- Microchip onthult hoe tumorcellen overgaan naar invasie
- Wiskundige modellen laten zien hoe organismen de som van hun genen overstijgen
- Unieke dendritische kleverige deeltjes gevormd door het benutten van vloeibare chaos
- Opwindend nieuw materiaal maakt gebruik van zonne-energie om door de mens gemaakte kleurstofverontreinigende stoffen uit water te verwijderen

- Complexe moleculen maken in slechts een paar stappen

- De chemie van radium onderzoeken om kankerbehandelingen vooruit te helpen met behulp van ioniserende straling
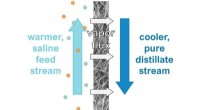
- Hoe maak je zout water beter schoon? Door ontziltingsgereedschappen droog te houden
 Asymmetrische structuur in het superzware zwarte gat in het centrum van de melkweg
Asymmetrische structuur in het superzware zwarte gat in het centrum van de melkweg Natuurkundigen observeren spontaan mechanisch knikken in vrijstaand grafeen
Natuurkundigen observeren spontaan mechanisch knikken in vrijstaand grafeen 3D-atoomstructuur van TRPML1-ionkanaal gepubliceerd
3D-atoomstructuur van TRPML1-ionkanaal gepubliceerd Hoe een biologisch diagram te tekenen
Hoe een biologisch diagram te tekenen  Groene infrastructuurplannen moeten rekening houden met historische raciale ongelijkheden, zeggen onderzoekers
Groene infrastructuurplannen moeten rekening houden met historische raciale ongelijkheden, zeggen onderzoekers  Onderzoekers demonstreren veelzijdigheid van solid-state eiwitsensor
Onderzoekers demonstreren veelzijdigheid van solid-state eiwitsensor Schaalbare fotonische computer lost het deelverzamelingsomprobleem op
Schaalbare fotonische computer lost het deelverzamelingsomprobleem op Waarom reageren het vaste natriumhydroxide en aluminiumpoeder niet als ze in een afgesloten verpakking worden bewaard?
Waarom reageren het vaste natriumhydroxide en aluminiumpoeder niet als ze in een afgesloten verpakking worden bewaard?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

