
Wetenschap
Bestaan er waterstofbruggen binnen een watermolecuul?
De waterstofbrug in een watermolecuul heeft een aanzienlijke invloed op de eigenschappen en het gedrag ervan. Hier zijn enkele belangrijke aspecten met betrekking tot waterstofbruggen in een watermolecuul:
1. Polariteit:De aanwezigheid van waterstofbruggen in water resulteert in de polariteit ervan. De gedeeltelijk positieve lading op de waterstofatomen en de gedeeltelijk negatieve lading op het zuurstofatoom creëren een dipoolmoment, waardoor water een polair molecuul wordt.
2. Cohesie en oppervlaktespanning:Waterstofbruggen zijn verantwoordelijk voor de cohesie van watermoleculen. Ze trekken watermoleculen aan en houden ze bij elkaar, wat bijdraagt aan de oppervlaktespanning van water. Oppervlaktespanning maakt verschijnselen mogelijk zoals waterparels op hydrofobe oppervlakken en de vorming van waterdruppels.
3. Hoog kookpunt:Waterstofbruggen in watermoleculen resulteren in een hoog kookpunt van 100°C (op zeeniveau). De sterke intermoleculaire krachten tussen watermoleculen vereisen meer energie om te overwinnen, wat leidt tot een hoger kookpunt vergeleken met andere moleculen van vergelijkbare grootte.
4. Hoge specifieke warmtecapaciteit:Water heeft een hoge specifieke warmtecapaciteit, wat betekent dat het een aanzienlijke hoeveelheid warmte kan opnemen of afgeven zonder een grote temperatuurverandering te ondergaan. Deze eigenschap wordt toegeschreven aan de energie die nodig is om de waterstofbruggen tussen watermoleculen te verbreken.
5. Solvatatie:Waterstofbindingen in watermoleculen maken het oplossen van veel polaire stoffen en ionen mogelijk. De gedeeltelijke ladingen van watermoleculen interageren met geladen deeltjes of polaire moleculen, omringen ze en scheiden ze van elkaar. Dit proces, bekend als solvatatie, is cruciaal voor de oplosbaarheid van stoffen in water.
Over het geheel genomen dragen de waterstofbruggen in een watermolecuul bij aan de unieke eigenschappen ervan en spelen ze een cruciale rol in verschillende biologische en chemische processen, inclusief processen die verband houden met waterprocessen en industriële toepassingen.
 Rode tij-opleving spoort ademhalingswaarschuwing op de stranden van Florida aan
Rode tij-opleving spoort ademhalingswaarschuwing op de stranden van Florida aan NASA vindt windschering die orkaan Kenneth . verzwakt
NASA vindt windschering die orkaan Kenneth . verzwakt Hoe zullen boomziekten reageren op klimaatverandering?
Hoe zullen boomziekten reageren op klimaatverandering?  Icy Ocean Worlds seismometer doorstaat verdere tests in Groenland
Icy Ocean Worlds seismometer doorstaat verdere tests in Groenland Systeem om ruimtestation te ontdoen van uitademingen van astronauten inspireert CO2-verwijdering op aarde
Systeem om ruimtestation te ontdoen van uitademingen van astronauten inspireert CO2-verwijdering op aarde
Hoofdlijnen
- Hoe zijn virussen, viroïden en prionen verwant?
- Haaienvinnenverboden helpen haaien misschien niet, wetenschappers zeggen:
- Studie identificeert een nieuwe topogenese-route voor het vouwen en assembleren van multi-overspannende membraaneiwitten
- Nauwkeurig bijhouden hoe plastic biologisch afbreekt
- eDNA-tool detecteert invasieve mosselen voordat ze hinderlijk worden
- Hoe microben de zoektocht naar buitenaards leven kunnen ondersteunen
- Wat is een eiwit? Een bioloog legt het uit
- Kwallen op het menu
- Een van 's werelds zeldzaamste walvissen waargenomen voor de kust van Californië
- Onderzoekers ontwikkelen hoogwaardige keramische brandstofcel die werkt op butaangas
- Glutamine-afhankelijke activering van celgroei ontdekt
- Legering met één atoom:uitstekende cokatalysator voor fotokatalyse
- Potentiële anti-verouderingscomponenten van Moringa oleifera blad
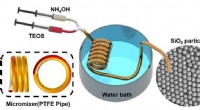
- Wetenschappers gebruiken een teflonpijp om een goedkope, eenvoudige reactor voor de synthese van silicadeeltjes
 Wetenschappers ontwikkelen methode om de porositeit van transparante materialen te berekenen
Wetenschappers ontwikkelen methode om de porositeit van transparante materialen te berekenen Lichtblauwe stip - of niet?
Lichtblauwe stip - of niet? Waarom wolken het ontbrekende stukje zijn in de puzzel over klimaatverandering
Waarom wolken het ontbrekende stukje zijn in de puzzel over klimaatverandering Twitteradvocaat zegt dat botgegevens die aan Musk zijn gegeven expliciet een schatting waren
Twitteradvocaat zegt dat botgegevens die aan Musk zijn gegeven expliciet een schatting waren Ruimtereizen kunnen je hersenen frituren, permanente leer- en geheugenproblemen veroorzaken
Ruimtereizen kunnen je hersenen frituren, permanente leer- en geheugenproblemen veroorzaken Sleutelgaten vinden in metalen 3D-printen
Sleutelgaten vinden in metalen 3D-printen Het delen van wetenschap is het meest waarschijnlijk onder mannelijke wetenschappers
Het delen van wetenschap is het meest waarschijnlijk onder mannelijke wetenschappers Hoe zorgt heet water ervoor dat DNA vrijkomt in de celkernen?
Hoe zorgt heet water ervoor dat DNA vrijkomt in de celkernen?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

