
Wetenschap
6 manieren om een chemisch evenwicht te verstoren?
2. De temperatuur wijzigen. Dit zal de snelheid van de voorwaartse en achterwaartse reacties beïnvloeden en zal daarom de evenwichtspositie verschuiven in de richting van de reactie die exotherm is. Als je bijvoorbeeld de temperatuur van een systeem verhoogt, verschuift het evenwicht in de richting van de reactie waarbij warmte vrijkomt. Als je de temperatuur verlaagt, verschuift het evenwicht in de richting van de reactie die warmte absorbeert.
3. De druk wijzigen. Dit heeft alleen invloed op de evenwichtspositie van een reactie als er sprake is van een verandering in het aantal mol gas. Als u bijvoorbeeld de druk verhoogt van een systeem dat een gasvormige reactant bevat, verschuift het evenwicht in de richting van de reactie die minder mol gas produceert. Als je de druk verlaagt, verschuift het evenwicht in de richting van de reactie die meer mol gas produceert.
4. Een katalysator toevoegen. Een katalysator versnelt de snelheid van een reactie zonder dat deze tijdens de reactie wordt verbruikt. Hierdoor verschuift de evenwichtspositie in de richting van de producten.
5. Het oplosmiddel vervangen. Dit kan de oplosbaarheid van de reactanten en producten beïnvloeden en daardoor de evenwichtspositie verschuiven. Als u bijvoorbeeld het oplosmiddel verandert van water in een niet-polair oplosmiddel, verschuift het evenwicht in de richting van de reactie die meer niet-polaire producten produceert.
6. Een elektrisch veld aanleggen. Dit kan de evenwichtspositie van een reactie beïnvloeden als er geladen soorten bij betrokken zijn. Als je bijvoorbeeld een elektrisch veld aanlegt op een systeem dat een positief geladen reactant en een negatief geladen product bevat, zal het evenwicht verschuiven in de richting van de reactie die meer positief geladen producten produceert. Als je het elektrische veld wegneemt, verschuift het evenwicht in de richting van de reactie die meer negatief geladen producten oplevert.
 Afstotend onderzoek:marine ontwikkelt scheepscoatings om brandstof te verminderen, energiekosten
Afstotend onderzoek:marine ontwikkelt scheepscoatings om brandstof te verminderen, energiekosten Zijn jodium en water homogeen of heterogeen?
Zijn jodium en water homogeen of heterogeen?  Welk type vloeistof gebruik je in een thermometer?
Welk type vloeistof gebruik je in een thermometer?  Welke twee delen vind je in de kern van een atoom?
Welke twee delen vind je in de kern van een atoom?  NIST-ontdekking zou de nauwkeurigheid kunnen vergroten bij het meten van de bloedstroom voor kankerdiagnose, andere toepassingen
NIST-ontdekking zou de nauwkeurigheid kunnen vergroten bij het meten van de bloedstroom voor kankerdiagnose, andere toepassingen
 Hoe onderzoekers water uit de lucht oogsten
Hoe onderzoekers water uit de lucht oogsten  Nieuw onderzoek berekent de capaciteit van Noord-Amerikaanse bossen om koolstof vast te leggen
Nieuw onderzoek berekent de capaciteit van Noord-Amerikaanse bossen om koolstof vast te leggen Manieren om lucht te meten
Manieren om lucht te meten  De combinatie van inheemse en wetenschappelijke kennis verbetert het brandbeheer in de Sahel
De combinatie van inheemse en wetenschappelijke kennis verbetert het brandbeheer in de Sahel Talloze branden verspreidden zich van noord naar zuid in Oregon
Talloze branden verspreidden zich van noord naar zuid in Oregon
Hoofdlijnen
- Wat zijn de regels voor een biologische tekening IN VERGROTING?
- Een kunstmatige eiwitschil maken om COVID-19 te bestrijden
- Beoordelingskader voor de instandhouding en het beheer van peulvruchtenplanten in Oost-Afrika aan de kust
- Onderzoekers ontdekken hoe CRISPR-eiwitten hun doelwit vinden
- Wie kan biologie-huiswerkhulp bieden tegen de laagste prijs?
- Onderzoekers beschrijven allereerste hybride vogelsoorten uit de Amazone
- Welke organellen hebben cellen nodig om actief transport te laten plaatsvinden?
- Uit langdurig onderzoek blijkt dat haring door klimaatverandering eerder in de Waddenzee arriveert
- Nieuw AI-systeem kan het gedrag van fruitvliegjes decoderen:waarom dat cruciaal is voor toekomstig onderzoek naar de menselijke genetica
- Moleculaire schatkaarten om nieuwe materialen te ontdekken

- Afgedankt afval kan een schat aan zeldzame metalen zijn

- Ontwikkeld multivalent zelf-geassembleerd bindereiwit tegen SARS-CoV-2 RBD
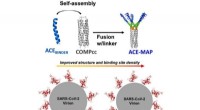
- Prestatievezel met van kleur veranderende coating maakt mechanische belasting zichtbaar

- Er komt iets slecht (ruikend) op deze manier - de wetenschap van stoffen en geuren

 Als je beter kijkt, zie je axiale filamenten in spicules van zeespons die uit eiwitten bestaan
Als je beter kijkt, zie je axiale filamenten in spicules van zeespons die uit eiwitten bestaan Supernova-verrassing creëert elementair mysterie
Supernova-verrassing creëert elementair mysterie Hollywood-stereotypen van vrouwelijke journalisten voeden een vicieuze cirkel van seksisme
Hollywood-stereotypen van vrouwelijke journalisten voeden een vicieuze cirkel van seksisme Hoe helpt biodiversiteit een ecosysteem?
Hoe helpt biodiversiteit een ecosysteem?  Chronische dysenterie was waarschijnlijk niet de moordenaar van Edward Black Prince, ondanks wat algemeen wordt aangenomen
Chronische dysenterie was waarschijnlijk niet de moordenaar van Edward Black Prince, ondanks wat algemeen wordt aangenomen  3 schot in YouTube-kantooraanval; verdacht gehate bedrijf
3 schot in YouTube-kantooraanval; verdacht gehate bedrijf De aankomende zonsverduistering is voor de NY State Corrections aanleiding om gevangenisbezoeken te annuleren
De aankomende zonsverduistering is voor de NY State Corrections aanleiding om gevangenisbezoeken te annuleren  8 beroemde parken ontworpen door Frederick Law Olmsted,
8 beroemde parken ontworpen door Frederick Law Olmsted,
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

