
Wetenschap
Waarom hebben aldehyden en ketonen lagere kookpunten dan hun overeenkomstige alcoholen?
1. Molecuulgewicht:Aldehyden en ketonen hebben lagere molecuulgewichten vergeleken met alcoholen met vergelijkbare koolstofketenlengtes. Het molecuulgewicht van een verbinding beïnvloedt het kookpunt, waarbij lichtere moleculen over het algemeen lagere kookpunten hebben.
2. Waterstofbinding:Alcoholen kunnen waterstofbruggen met elkaar vormen vanwege de aanwezigheid van de hydroxylgroep (-OH). Waterstofbinding is een sterke intermoleculaire kracht die resulteert in hogere kookpunten. Aldehyden en ketonen daarentegen missen het vermogen om waterstofbruggen te vormen. In plaats daarvan maken ze gebruik van zwakkere Van der Waals-krachten, die minder effectief zijn in het bij elkaar houden van moleculen.
3. Polariteit:Aldehyden en ketonen zijn minder polair dan alcoholen. De C=O-binding in aldehyden en ketonen is polair, maar de algehele polariteit van het molecuul wordt verminderd vanwege de symmetrische verdeling van de elektronendichtheid. Alcoholen hebben, met hun polaire O-H-binding, een sterkere polariteit, wat de intermoleculaire interacties verbetert en tot hogere kookpunten leidt.
4. Moleculaire grootte en vorm:Aldehyden en ketonen hebben compactere moleculaire structuren vergeleken met alcoholen. De aanwezigheid van de -OH-groep in alcoholen introduceert extra bulk en asymmetrie in het molecuul. De kleinere omvang en symmetrische vorm van aldehyden en ketonen zorgen voor een nauwere pakking, wat resulteert in zwakkere intermoleculaire krachten en lagere kookpunten.
Samenvattend kunnen de lagere kookpunten van aldehyden en ketonen in vergelijking met alcoholen worden toegeschreven aan hun lagere molecuulgewichten, zwakkere intermoleculaire krachten (door de afwezigheid van waterstofbinding), verminderde polariteit en compactere moleculaire structuren.
 Efficiënte kettingoverdracht voor 3D-printen van taaie fotopolymeren
Efficiënte kettingoverdracht voor 3D-printen van taaie fotopolymeren Noem de functie van aminozuren in de poolgebieden op het enzym op de actieve plaats?
Noem de functie van aminozuren in de poolgebieden op het enzym op de actieve plaats?  Waarom wordt zuur gebruikt om glaskralen schoon te maken?
Waarom wordt zuur gebruikt om glaskralen schoon te maken?  Giftige PFAS detecteren met een sensor ter grootte van een chip
Giftige PFAS detecteren met een sensor ter grootte van een chip Eigenschappen van Kerosene
Eigenschappen van Kerosene
 Nieuw onderzoek vindt ongekende verzwakking van Aziatische zomermoesson
Nieuw onderzoek vindt ongekende verzwakking van Aziatische zomermoesson Onbekende stromingen in de Zuidelijke Oceaan zijn waargenomen met behulp van zeehonden
Onbekende stromingen in de Zuidelijke Oceaan zijn waargenomen met behulp van zeehonden Hoe gymnasten te beschermen tegen gevaarlijke chemicaliën in sportschoolfaciliteiten?
Hoe gymnasten te beschermen tegen gevaarlijke chemicaliën in sportschoolfaciliteiten? Milieuvriendelijke programma's moeten rekening houden met de factoren die elk geslacht motiveren
Milieuvriendelijke programma's moeten rekening houden met de factoren die elk geslacht motiveren Nieuwe, gelijke Earth 2D-kaart biedt een beter perspectief op de wereld
Nieuwe, gelijke Earth 2D-kaart biedt een beter perspectief op de wereld
Hoofdlijnen
- Hoe een prokaryotisch celmodel te maken
- Kwam Eiwit, DNA of RNA als eerste?
- Getoonde chimpansees die spontaan om de beurt een cijferpuzzel oplossen
- Ultraconserverde elementen in het genoom:zijn ze onmisbaar?
- Bladeren, grazen, paren:voedsel en gezelschap helpen dieren in gevangenschap
- Wetenschappers ontdekken een genetisch mechanisme dat het opbrengstpotentieel van graangewassen zou kunnen verbeteren
- Voors en tegens van Cloning Plants & Animals
- Hoe nieuwe lussen in DNA-verpakkingen ons helpen diverse antilichamen te maken
- Onderzoek laat zien hoe slijm microben temt
- Nieuwe immunoassaytechniek meet extreem lage concentraties van kleine moleculen met behulp van detectie van één molecuul
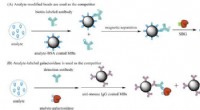
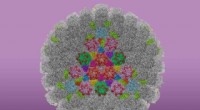
- Studie levert tot nu toe de duidelijkste beelden van HSV-1 op, het virus dat koortsblaasjes veroorzaakt
- Hoop op ontwikkeling van materialen voor 3D-displays en medische toepassingen
- Een roos inspireert slimme manier om water op te vangen en te zuiveren

- Bacteriën eten broeikasgas met een kant van eiwit

 Europese piloten diep verontrust door mogelijke terugkeer 737 MAX
Europese piloten diep verontrust door mogelijke terugkeer 737 MAX Hoe u vacatures van siliciumcarbide omzet in kwantuminformatie
Hoe u vacatures van siliciumcarbide omzet in kwantuminformatie Nanobuisjes slagen voor zuurtest
Nanobuisjes slagen voor zuurtest Atlantas Airport Ramp klinkt Luchtvaart Alarm Bell
Atlantas Airport Ramp klinkt Luchtvaart Alarm Bell  Omgedraaide metaaloxide kooi kan kooldioxide scheiden van koolmonoxide
Omgedraaide metaaloxide kooi kan kooldioxide scheiden van koolmonoxide VN:Quick wins nodig om klimaatdoelen binnen bereik te houden
VN:Quick wins nodig om klimaatdoelen binnen bereik te houden Methaan:emissies nemen toe en dat is geen goed nieuws
Methaan:emissies nemen toe en dat is geen goed nieuws Toevallige ontdekking van nanodeeltjes zou een revolutie in de productie kunnen zijn
Toevallige ontdekking van nanodeeltjes zou een revolutie in de productie kunnen zijn
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

