
Wetenschap
Aluminium reageert met verdund zwavelzuur om aluminiumsulfaat en waterstof te produceren?
$$2Al(s) + 3H_2SO_4(aq) → Al_2(SO_4)_3(aq) + 3H_2(g)$$
Uitleg:
Aluminium is een reactief metaal en reageert met verdund zwavelzuur om aluminiumsulfaat en waterstofgas te produceren. De reactie is exotherm, wat betekent dat er warmte vrijkomt. Het waterstofgas dat bij de reactie ontstaat, is brandbaar en kan als brandstof worden gebruikt. Aluminiumsulfaat is een witte, kristallijne vaste stof die oplosbaar is in water. Het wordt gebruikt in een verscheidenheid aan toepassingen, waaronder het maken van papier, waterzuivering en als bijtmiddel bij het verven.
De reactie tussen aluminium en verdund zwavelzuur kan worden opgesplitst in twee halfreacties:
Oxidatiehalfreactie:
$$2Al(s) → 2Al^{3+}(aq) + 6e^-$$
Reductie-halfreactie:
$$6H^+ (aq) + 6e^- → 3H_2(g)$$
De totale reactie is de som van de twee halfreacties:
$$2Al(s) + 6H^+(aq) → 2Al^{3+}(aq) + 3H_2(g)$$
Deze reactie is een voorbeeld van een redoxreactie, waarbij de ene stof wordt geoxideerd (elektronen verliest) en een andere stof wordt gereduceerd (elektronen wint). In dit geval wordt aluminium geoxideerd en wordt waterstof gereduceerd.
 Maak een lijst van de drie soorten straling die worden afgegeven tijdens radioactief verval
Maak een lijst van de drie soorten straling die worden afgegeven tijdens radioactief verval Wat gebeurt er met een metaal dat wordt blootgesteld aan zure mengsels?
Wat gebeurt er met een metaal dat wordt blootgesteld aan zure mengsels?  Onderzoekers observeren direct de membraanbinding van α-synucleïne in levende cellen
Onderzoekers observeren direct de membraanbinding van α-synucleïne in levende cellen E. coli gebruiken om bioproducten te maken, zoals biodiesel, op een kosteneffectieve manier
E. coli gebruiken om bioproducten te maken, zoals biodiesel, op een kosteneffectieve manier Wat is het verschil tussen ISO-kwaliteiten van olie?
Wat is het verschil tussen ISO-kwaliteiten van olie?
 Wetenschappers ontdekken breuksysteem in Zuidoost-Nepal
Wetenschappers ontdekken breuksysteem in Zuidoost-Nepal Zeldzame gletsjeronderzoeksnotitieboekjes nu digitaal verkrijgbaar
Zeldzame gletsjeronderzoeksnotitieboekjes nu digitaal verkrijgbaar Wetenschappers tonen aan dat droogtetolerante gewassen schil nodig hebben
Wetenschappers tonen aan dat droogtetolerante gewassen schil nodig hebben  Toename van bosbranden waardoor slechte luchtdagen in het noordwesten van de VS de afgelopen 28 jaar erger zijn geworden
Toename van bosbranden waardoor slechte luchtdagen in het noordwesten van de VS de afgelopen 28 jaar erger zijn geworden Kwantummechanica in de kern van de aarde
Kwantummechanica in de kern van de aarde
Hoofdlijnen
- Facebook verandert de manier waarop het 'nepnieuws'-verhalen identificeert
- Vorm geven aan de manier waarop de vervormbaarheid van rode bloedcellen wordt beoordeeld:onderzoekers ontwikkelen een nieuwe aanpak
- Grote baby's, kleine moeders:Tseetseevliegen vertonen extreem moederschap
- Vechten tegen bubbels:hoe planten zichzelf beschermen tegen dodelijke schimmels
- Chromosomen wisselen genetische informatie uit via het proces waarvan?
- Vermont ziet hedendaags record voor reproductie van Amerikaanse zeearenden
- Hoe een Silly Putty-ingrediënt stamceltherapieën zou kunnen bevorderen
- Moeten dieren stemrecht hebben?
- Nieuwe modellen stellen oude aannames in vraag over hoeveel moleculen er nodig zijn om de celdeling te controleren
- Opschalen naar nieuwe hoogten met gekko-geïnspireerde lijm

- Geïntegreerde lab-on-a-chip gebruikt smartphone om snel meerdere ziekteverwekkers te detecteren

- Op zoek naar de chemie van het leven

- Bindmiddelvrij titanosilicaat van het type MWW voor selectieve en duurzame epoxidatie van propyleen
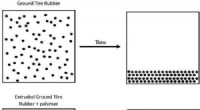
- Polymeren effenen de weg voor een breder gebruik van gerecyclede banden in asfalt
 Hoe hydraulische kranen werken
Hoe hydraulische kranen werken  Maanlanders kunnen instant landingsplatforms spuiten als ze bij de maan aankomen
Maanlanders kunnen instant landingsplatforms spuiten als ze bij de maan aankomen Kan intuïtief bouwontwerp een actieve schutter helpen stoppen?
Kan intuïtief bouwontwerp een actieve schutter helpen stoppen? De fysieke structuur van robots evolueren om de prestaties in verschillende omgevingen te verbeteren
De fysieke structuur van robots evolueren om de prestaties in verschillende omgevingen te verbeteren Zorgt een verminderde dampdruk op grote hoogte ervoor dat een vloeistof bij hogere temperaturen gaat koken?
Zorgt een verminderde dampdruk op grote hoogte ervoor dat een vloeistof bij hogere temperaturen gaat koken?  Hoe de grootte van een aardgeleider
Hoe de grootte van een aardgeleider Wetenschap doen, in plaats van wetenschappers te zijn, meer bemoedigend voor degenen die ondervertegenwoordigd zijn in het veld
Wetenschap doen, in plaats van wetenschappers te zijn, meer bemoedigend voor degenen die ondervertegenwoordigd zijn in het veld Aziatische bossen tonen veerkracht ondanks toenemende verstoringen als gevolg van klimaatverandering en menselijke activiteiten
Aziatische bossen tonen veerkracht ondanks toenemende verstoringen als gevolg van klimaatverandering en menselijke activiteiten
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

