
Wetenschap
Onderzoekers observeren direct de membraanbinding van α-synucleïne in levende cellen
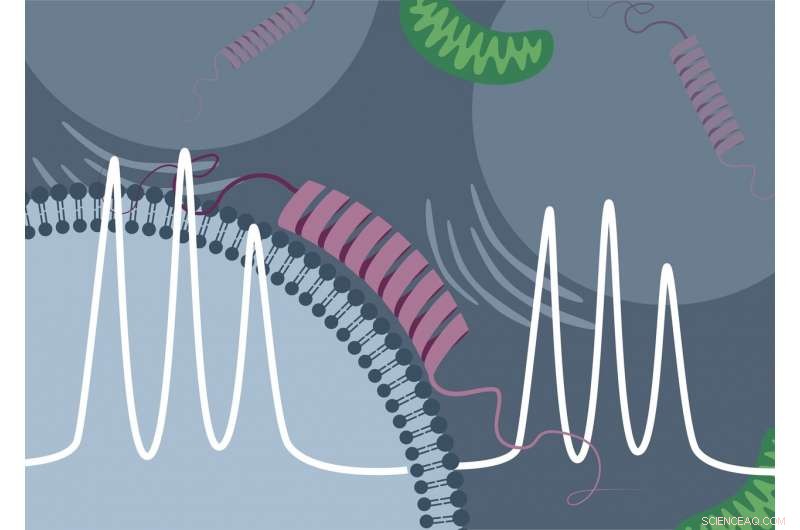
Wetenschappers van de Universiteit van Konstanz en de Vrije Universiteit van Amsterdam, in samenwerking met het Bruker BioSpin ontwikkelteam, zijn voor het eerst geslaagd in de directe spectroscopische detectie van de binding van het "Parkinson-eiwit" -synucleïne aan lipidemembranen in de cel. Credit:Malte Drescher Lab - Universiteit van Konstanz
Het eiwit α-synucleïne is een van de meest voorkomende eiwitten in het menselijk brein. Het wordt vaak het "Parkinson-eiwit, " aangezien afzetting van dit eiwit in hersencellen een kenmerk is van de ziekte van Parkinson. Ondanks de grote belangstelling van biomedisch onderzoek naar het eiwit, veel vragen met betrekking tot de functie en fysiologie van α-synucleïne in levende cellen moeten nog worden beantwoord. Bijvoorbeeld, het was voorheen onduidelijk of en in welke mate het eiwit bindt aan en interageert met interne celcomponenten zoals membranen.
Aangezien dergelijke processen een rol kunnen spelen bij de ontwikkeling van de ziekte, het team onder leiding van de in Konstanz gevestigde fysisch chemicus professor Malte Drescher gebruikte de verdere ontwikkeling van een gevestigde meetmethode genaamd elektronenparamagnetische resonantiespectroscopie (EPR-spectroscopie) om meer te weten te komen over de bindende eigenschappen van het Parkinson-eiwit. De studie, gepubliceerd in het wetenschappelijke tijdschrift The Journal of Physical Chemistry Letters , levert proof of concept dat de geavanceerde methode fundamenteel geschikt is voor het ophelderen van eiwit-lipide-interacties in cellen. Verder, deze eerste praktische test leverde direct bewijs op van de binding van α-synucleïne aan intracellulaire membranen.
Langzamer is niet altijd grondiger
De geavanceerde versie van EPR-spectroscopie, in de huidige studie die voor het eerst in de praktijk wordt gebruikt, wordt rapid-scan EPR-spectroscopie genoemd. Bij beide methoden de conventionele en de geavanceerde, de te onderzoeken eiwitten worden eerst voorzien van zogenaamde spinprobes. Deze chemische sondes maken het mogelijk om veranderingen in de eiwitstructuur te detecteren. Spinsondes hebben elk een vrij elektron waarvan de spin wordt geëxciteerd door bestraling met microgolven. "We kunnen ons spins voorstellen als kleine kompasnaalden die tijdens de meting worden beïnvloed door microgolfstraling, " legt Drescher uit. Bij conventionele EPR-spectroscopie, voor elke groep aangeslagen spins moet gewacht worden tot deze invloed wegsterft voordat de groep weer aangeslagen kan worden. Dit relatief tijdrovende proces moet meerdere keren worden herhaald om de volledige meting te bereiken.
Met rapid-scan EPR-spectroscopie, daarentegen, het is niet meer nodig om te wachten tot de invloed op een spingroep afneemt voordat de meting wordt voortgezet. "In plaats daarvan, je haast de invloed spectraal van spingroep naar spingroep en keert dan terug naar de eerste groep op het moment dat de opwinding net is afgenomen, " zegt Drescher. Aan de ene kant, deze procedure verkort de vereiste meettijd, terwijl het anderzijds de toepassing van een hoger microgolfvermogen mogelijk maakt, wat leidt tot een betere nauwkeurigheid van de methode. De onderzoekers hebben van beide voordelen gebruik gemaakt in hun huidige onderzoek naar het bindingsgedrag van α-synucleïne.
De nieuwe methode in de praktijk
Uit eerdere in vitro onderzoeken ("in de reageerbuis") was al bekend dat het "Parkinson-eiwit" -synucleïne zich kan hechten aan elektrisch negatief geladen lipidemembranen. Bij EPR-spectroscopie wordt dit bindingsproces gaat gepaard met een karakteristieke verandering in het gemeten signaal. "Het aanvankelijk ongeordende α-synucleïne neemt een geordende vorm aan bij binding aan het membraan. Dit vermindert de mobiliteit van de spin-probe, en de binding van het eiwit kan direct worden gedetecteerd door de meetmethode, " legt Theresa Braun uit, promovendus in het onderzoeksteam van Drescher en, samen met Juliane Stehle, hoofdauteur van de studie.
Met behulp van synthetische, negatief geladen membraanblaasjes en gezuiverd α-synucleïne, Drescher en zijn collega's konden dezelfde signaalverandering detecteren in rapid-scan EPR-spectroscopie. Echter, ze slaagden er niet alleen in vitro in, maar ook in cellen van de Afrikaanse klauwkikker (Xenopus laevis), waarin eerst de kunstmatige membraanblaasjes werden ingebracht en, korte tijd later, het eiwit was. Het onderzoeksteam voerde vervolgens tijdsafhankelijke metingen uit en kon direct observeren, gebaseerd op de verandering in het meetsignaal, hoe het aandeel van het in de cel gebonden eiwit in de loop van de tijd toenam.
Een vergelijkbare, zij het aanzienlijk zwakkere, toename van de hoeveelheid gebonden α-synucleïne in de tijd werd ook gezien wanneer er geen kunstmatige membranen in de cel werden ingebracht. Dus, volgens Drescher, er bleef slechts één verklaring over voor deze cruciale observatie. "Dit is de eerste keer dat we direct bewijs zien dat α-synucleïne interageert met de endogene, d.w.z. ook van nature bestaande lipidemembranen, " concludeert de wetenschapper. Vanwege de relatief kleine omvang van het effect, bij experimenten met minder nauwkeurige meetmethoden was dit voorheen verborgen gebleven.
Van kikker tot mens
In toekomstige studies, Het team van Malte Drescher is van plan voort te bouwen op dit resultaat en het proces van intracellulaire binding van α-synucleïne aan natuurlijke celcomponenten verder op te helderen, om meer te weten te komen over de functie van het eiwit. Een belangrijke stap in dit proces is de overstap van kikkercellen als modelsysteem naar verschillende zoogdierceltypes. Het doel op lange termijn is om de eiwit-lipide-interacties van het "Parkinson-eiwit" en zijn rol in de ontwikkeling van de ziekte van Parkinson beter te begrijpen om geschikte therapeutische benaderingen te kunnen ontwikkelen.
 Om mosselen op te bouwen, je moet je vissen kennen
Om mosselen op te bouwen, je moet je vissen kennen Dodental overstromingen Indonesië loopt op tot 89 tientallen vermisten
Dodental overstromingen Indonesië loopt op tot 89 tientallen vermisten De effecten van niet recycleren
De effecten van niet recycleren Stroomstoringen blijven voor miljoenen aanhouden terwijl een nieuwe ijzige storm opdoemt
Stroomstoringen blijven voor miljoenen aanhouden terwijl een nieuwe ijzige storm opdoemt Het verhogen van het grondwaterpeil in landbouwveengebieden kan de sleutel zijn tot het verminderen van de uitstoot van broeikasgassen in het VK
Het verhogen van het grondwaterpeil in landbouwveengebieden kan de sleutel zijn tot het verminderen van de uitstoot van broeikasgassen in het VK
Hoofdlijnen
- Waarom kunnen we de voetstappen van anderen horen,
- Amfibieën redden van een dodelijke schimmel betekent handelen zonder alle antwoorden te weten
- De vreemde empathie van plaatsvervangende schaamte
- Energiebesparende LED's stimuleren wereldwijd lichtvervuiling
- Kan graszaad net zo goed groeien op een lavasteen als op aarde?
- EU impasse over onkruidverdelger gaat in beroep
- Leven in drijfhout in zee:het geval van drijfhoutspecialist talitrids
- Saguaro en andere torenhoge cactussen hebben een roerige geschiedenis
- Luipaard gevangen na 36 uur op jacht naar fabriek in India
- Supercomputers helpen de eiwitassemblage op te laden
- 3D-structuur van enzym opent pad naar nieuw medicijnontwerp bij hersenziekte
- Wat is een synthesereactie?

- Superflexibele aerogels zijn zeer efficiënte absorptiemiddelen, thermische isolatoren, en druksensoren

- Nanokatalysator maakt zwaar werk van mierenzuur
 Facebook doet, inderdaad, wil je oproepen op het apparaat volgen
Facebook doet, inderdaad, wil je oproepen op het apparaat volgen De kracht van AI en high-performance computing benutten om de evolutie uit te breiden naar supergeleiders
De kracht van AI en high-performance computing benutten om de evolutie uit te breiden naar supergeleiders FedEx test SameDay Bot voor lokale leveringen (update)
FedEx test SameDay Bot voor lokale leveringen (update) Stellaire eieren nabij galactisch centrum komen uit in babysterren
Stellaire eieren nabij galactisch centrum komen uit in babysterren Virtual reality-tour brengt Jeruzalem uit de bijbel tot leven
Virtual reality-tour brengt Jeruzalem uit de bijbel tot leven Toyota Q1 nettowinst bijna 4% gestegen, jaarwinst naar beneden bijgesteld
Toyota Q1 nettowinst bijna 4% gestegen, jaarwinst naar beneden bijgesteld Quantumbits in twee dimensies
Quantumbits in twee dimensies Oude gigantische gepantserde vissen die op dezelfde manier worden gevoerd als reuzenhaaien
Oude gigantische gepantserde vissen die op dezelfde manier worden gevoerd als reuzenhaaien
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Swedish | German | Dutch | Danish | Norway | Portuguese |

-
Wetenschap © https://nl.scienceaq.com

