
Wetenschap
Als metaal grijs is en zuurstof een kleurloos gas, waarom heeft roest dan een roodbruine kleur?
1. Oxidatie:IJzer ondergaat oxidatie, waarbij elektronen verloren gaan aan zuurstofatomen. Dit proces zet elementair ijzer (Fe) om in ijzerionen (Fe2+).
2. Hydratatie:Watermoleculen omringen de ijzerionen en vormen gehydrateerde ionen die aquatische ijzer(II)-ionen worden genoemd (Fe(H2O)6^2+).
3. Verdere oxidatie:In aanwezigheid van zuurstof en vocht ondergaan de geaquateerde ijzer(II)-ionen verdere oxidatie, waarbij ze meer elektronen verliezen om ijzer(III)-ionen (Fe3+) te worden.
4. Hydrolyse:De ijzer(III)-ionen reageren met watermoleculen en ondergaan hydrolyse om ijzer(III)hydroxide (Fe(OH)3) te vormen.
5. Uitdroging en vorming van ijzeroxide:IJzer(III)hydroxide is aanvankelijk een gelatineus, groenachtig bruin neerslag. Na verloop van tijd verliest dit neerslag watermoleculen door uitdroging en wordt het omgezet in ijzer(III)oxide (Fe2O3), het belangrijkste bestanddeel van roest.
De roodbruine kleur van roest is kenmerkend voor Fe2O3. Het is belangrijk op te merken dat de exacte kleur en samenstelling van roest kan variëren, afhankelijk van factoren zoals het type metaal, de omgeving en het stadium van het oxidatieproces.
 Onderzoekers ontdekken structuur van anti-verouderingshormoon
Onderzoekers ontdekken structuur van anti-verouderingshormoon Wat zijn de ingrediënten in Egyptische muskusolie?
Wat zijn de ingrediënten in Egyptische muskusolie?  Studie onthult nieuwe hindernis voor de ontwikkeling van immunotherapieën
Studie onthult nieuwe hindernis voor de ontwikkeling van immunotherapieën Nieuwe moleculaire meerstaps fotoschakelaars op heterdaad betrapt
Nieuwe moleculaire meerstaps fotoschakelaars op heterdaad betrapt Nieuw waargenomen eenwaardige calciumionen vertonen onverwachte metaalachtigheid en ferromagnetisme
Nieuw waargenomen eenwaardige calciumionen vertonen onverwachte metaalachtigheid en ferromagnetisme
 Hoe is fruit gevormd in planten?
Hoe is fruit gevormd in planten?  Nieuwe bedreiging voor het Victoriameer?
Nieuwe bedreiging voor het Victoriameer?  Klimaatverandering om sommige Amerikaanse waterbassins uit te putten, de opbrengst van geïrrigeerde gewassen verminderen
Klimaatverandering om sommige Amerikaanse waterbassins uit te putten, de opbrengst van geïrrigeerde gewassen verminderen Klimaatverandering zal bosbranden voeden:experts
Klimaatverandering zal bosbranden voeden:experts Vrouwen kunnen de dupe worden van de gevolgen van klimaatveranderingen
Vrouwen kunnen de dupe worden van de gevolgen van klimaatveranderingen
Hoofdlijnen
- Heeft vruchtbaarheid invloed op de lichaamsgeur van een vrouw? Studie vindt geen bewijs
- Onderzoekers kijken naar de fruitvlieg om het menselijk brein te begrijpen
- Avocado's zijn 'slecht' en veganisten belachelijk:hoe we het eten van te veel vlees rechtvaardigen
- Hoe menselijke migratie werkt
- Oedogonium Life Cycle
- Man of vrouw? Wetenschappers ontdekken het genetische mechanisme dat de geslachtsontwikkeling bij vlinders bepaalt
- De puzzel van niet-waardresistentie:waarom beschadigen ziekteverwekkers sommige planten, maar andere niet?
- Hebben planten het potentieel om te vaccineren tegen HIV?
- Hoe communiceren de lever en de nieren en welke hormonen worden gebruikt?
- Wetenschappers suggereren een nieuwe methode voor het synthetiseren van een veelbelovend magnetisch materiaal

- Het aangaan van een 100 jaar oude uitdaging zou de weg kunnen banen naar digitale aroma's

- Hiërarchisch 3D-printen van nanoporeus goud kan een revolutie teweegbrengen in het ontwerp van elektrochemische reactoren

- Nieuw proces van bacteriën en algen kan helpen om het Britse leger koolstofarm te maken

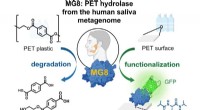
- Enzym in menselijke speekselmicroben breekt plastics op PET-basis af
 Waarom paarsgekroonde sprookjes zich bezighouden met coöperatief fokken
Waarom paarsgekroonde sprookjes zich bezighouden met coöperatief fokken  Simulaties laten zien hoe de dominante SARS-CoV-2-stam zich aan de gastheer bindt en antilichamen bezwijkt
Simulaties laten zien hoe de dominante SARS-CoV-2-stam zich aan de gastheer bindt en antilichamen bezwijkt  Doomsday prepping in tijden van coronavirus
Doomsday prepping in tijden van coronavirus Baanbrekende volledig solid-state batterijtechnologie
Baanbrekende volledig solid-state batterijtechnologie Elon Musk maakt een onzedelijke grap bij Jeff Bezos nieuwe Blue Moon-lander
Elon Musk maakt een onzedelijke grap bij Jeff Bezos nieuwe Blue Moon-lander Virgin Galactic onthult commerciële ruimtepakken
Virgin Galactic onthult commerciële ruimtepakken Neutronenonderzoek naar zelfassemblerende films voor het oogsten van zonne-energie onthult een nieuwe goedkope tool voor het printen van 3D-circuits
Neutronenonderzoek naar zelfassemblerende films voor het oogsten van zonne-energie onthult een nieuwe goedkope tool voor het printen van 3D-circuits El Nino vervaagt, dus voorspellers verwachten een drukker orkaanseizoen
El Nino vervaagt, dus voorspellers verwachten een drukker orkaanseizoen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

