
Wetenschap
Wat proberen de atomen te bereiken als ze zich binden met andere atomen?
Er zijn drie hoofdtypen chemische bindingen:covalente bindingen, ionische bindingen en metaalbindingen.
* Covalente bindingen treedt op wanneer twee of meer atomen elektronen delen. Dit type binding is de sterkste en meest voorkomende.
* Ionische bindingen ontstaat wanneer een atoom elektronen overdraagt aan een ander atoom. Dit type binding is zwakker dan een covalente binding, maar nog steeds sterk.
* Metaalverbindingen treedt op wanneer de atomen in een metaal een elektronenpool delen. Dit type binding is het zwakst, maar nog steeds sterk genoeg om de atomen in een vaste stof bij elkaar te houden.
Het type binding dat tussen twee atomen ontstaat, hangt af van de elektronegativiteit van de atomen. Elektronegativiteit is een maatstaf voor het vermogen van een atoom om elektronen aan te trekken. Hoe groter het verschil in elektronegativiteit tussen twee atomen, hoe groter de kans dat ze een ionische binding vormen.
Natrium en chloor hebben bijvoorbeeld een groot verschil in elektronegativiteit. Natrium heeft een lage elektronegativiteit en wordt dus gemakkelijk geoxideerd. Chloor heeft een hoge elektronegativiteit en kan dus gemakkelijk worden gereduceerd. Wanneer natrium en chloor een binding aangaan, draagt natrium zijn elektron over aan chloor, waardoor een ionische binding ontstaat.
Daarentegen hebben koolstof en waterstof een klein verschil in elektronegativiteit. Dit betekent dat ze waarschijnlijk allebei elektronen delen. Wanneer koolstof en waterstof zich binden, vormen ze een covalente binding.
Het type binding dat zich tussen twee atomen vormt, heeft een aanzienlijke invloed op de eigenschappen van de resulterende verbinding. Ionische verbindingen zijn bijvoorbeeld doorgaans hard, bros en hebben hoge smeltpunten. Covalente verbindingen zijn doorgaans zacht, flexibel en hebben lage smeltpunten. Metaalverbindingen zijn doorgaans glanzend, kneedbaar en taai.
 Vermindering van plasticvervuiling door op RNA geïnspireerde breekpunten toe te voegen
Vermindering van plasticvervuiling door op RNA geïnspireerde breekpunten toe te voegen Welk type kernreactie vindt plaats in een reactor?
Welk type kernreactie vindt plaats in een reactor?  Zijdevezels verbeteren bioinkt voor 3D-geprinte kunstmatige weefsels en organen
Zijdevezels verbeteren bioinkt voor 3D-geprinte kunstmatige weefsels en organen Chemische vergelijking voor het verbranden van fossiele brandstoffen?
Chemische vergelijking voor het verbranden van fossiele brandstoffen?  Psoriasis voorkomen met vanilline
Psoriasis voorkomen met vanilline
 Opinie:het is onzin om te zeggen dat fracking veilig kan worden gemaakt, welke richtlijnen we ook bedenken
Opinie:het is onzin om te zeggen dat fracking veilig kan worden gemaakt, welke richtlijnen we ook bedenken Op de Balkan, winters gejuich wordt verduisterd door een giftige smog
Op de Balkan, winters gejuich wordt verduisterd door een giftige smog Hoe ijsberen in stand kunnen worden gehouden – en de oogst voor eigen gebruik in stand kan worden gehouden – onder klimaatverandering
Hoe ijsberen in stand kunnen worden gehouden – en de oogst voor eigen gebruik in stand kan worden gehouden – onder klimaatverandering  Vier geografische factoren die invloed hebben op cultuur
Vier geografische factoren die invloed hebben op cultuur Nieuwe Australische wet moet het Great Barrier Reef helpen redden
Nieuwe Australische wet moet het Great Barrier Reef helpen redden
Hoofdlijnen
- Onze darmmicroben hebben circadiane ritmes,
- De lange en korte van een supergen voor efficiënte bestuiving
- Kamgelei mogelijk eerste afstamming van evolutionaire boom
- Snel leven, jong sterven:studie onthult de impact van habitatverstoring op de sociale organisatie van Arabische babbelaars
- Wil een mutatie de evolutie beïnvloeden, dan moet deze plaatsvinden in?
- Genetische studie onthult seksgeheimen van schimmels werpt licht op candidiasis
- Welke van de volgende is het meest waarschijnlijk het gevolg van een organisme met lipiden in zijn lichaam?
- Hoe bewegen onze cellen? Vloeistofdruppels zouden dit kunnen verklaren
- Uitzonderlijk goed bewaarde haaienfossielen uit de tijd van de dinosauriërs die in Mexico zijn geïdentificeerd
- Metamaterialen bieden multifunctionele materialen voor engineering

- Onderzoekers creëren vloeistofafstotende substantie die op alle oppervlakken werkt

- Zwart plastic kan niet worden gerecycled, maar we hebben zojuist een manier gevonden om de koolstof in hernieuwbare energie te gebruiken

- Volatiliteitsverrassingen ontstaan bij het verwijderen van overtollig waterstof

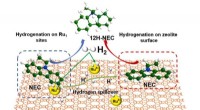
- Synergistische katalysatoren voor zeer efficiënte waterstofopslag
 Rendieren werden veel eerder gedomesticeerd dan eerder werd gedacht, nieuwe studie suggereert:
Rendieren werden veel eerder gedomesticeerd dan eerder werd gedacht, nieuwe studie suggereert: Wegen om de belofte van volledig solid-state batterijen waar te maken
Wegen om de belofte van volledig solid-state batterijen waar te maken Wat zijn de vijf biotische factoren van een aquatisch ecosysteem?
Wat zijn de vijf biotische factoren van een aquatisch ecosysteem?  Levensgroot papieren eerbetoon aan Suffragette-iconen en ter ere van 100 jaar vrouwenstemrecht
Levensgroot papieren eerbetoon aan Suffragette-iconen en ter ere van 100 jaar vrouwenstemrecht De eigenschappen van een 2-D fermi-gas onderzoeken
De eigenschappen van een 2-D fermi-gas onderzoeken Gigantische tienerhaai uit het dinosaurustijdperk geïdentificeerd aan de hand van wervelresten
Gigantische tienerhaai uit het dinosaurustijdperk geïdentificeerd aan de hand van wervelresten Nieuwe kolenregelgeving zal tot 1400 Amerikanen per jaar doden
Nieuwe kolenregelgeving zal tot 1400 Amerikanen per jaar doden Veranderingen in het zwaartekrachtveld van de aarde:unieke gegevensreeksen worden vervolgd
Veranderingen in het zwaartekrachtveld van de aarde:unieke gegevensreeksen worden vervolgd
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

