
Wetenschap
Hoe werken koolzuur en bicarbonaat om de pH-waarde van het bloed op peil te houden?
Hoe werkt het koolzuur-bicarbonaatbuffersysteem?
1. Productie van kooldioxide (CO2) :Cellulaire ademhaling en metabolische processen in weefsels produceren koolstofdioxide (CO2) als afvalproduct. CO2 diffundeert in de bloedbaan.
2. Vorming van koolzuur :In de bloedbaan reageert CO2 met water (H2O) om koolzuur (H2CO3) te vormen. Deze reactie wordt gekatalyseerd door het enzym koolzuuranhydrase, dat overvloedig aanwezig is in rode bloedcellen.
CO2 + H2O ⇌ H2CO3
3. Dissociatie van koolzuur :Koolzuur is een zwak zuur en ondergaat dissociatie om waterstofionen (H+) en bicarbonaationen (HCO3-) te produceren.
H2CO3 ⇌ H+ + HCO3-
4. Bufferingsactie :De waterstofionen (H+) die vrijkomen bij de dissociatie van koolzuur kunnen worden geneutraliseerd door bicarbonaationen (HCO3-), waardoor opnieuw koolzuur wordt gevormd. Deze omkeerbare reactie helpt de pH van het bloed binnen een stabiel bereik te houden.
H+ + HCO3- ⇌ H2CO3
De verhouding van bicarbonaationen (HCO3-) tot koolzuur (H2CO3) in het bloed bepaalt de pH. Wanneer de concentratie HCO3- hoger is ten opzichte van H2CO3, neemt de pH van het bloed toe, waardoor het alkalischer wordt. Omgekeerd, wanneer de concentratie H2CO3 hoger is ten opzichte van HCO3-, daalt de pH, waardoor het bloed zuurder wordt.
Regulering van het koolzuur-bicarbonaatbuffersysteem:
Het koolzuur-bicarbonaatbuffersysteem wordt gereguleerd door verschillende mechanismen, waaronder:
- Ademhalingscontrole: Het ademhalingssysteem regelt de hoeveelheid CO2 in het bloed. Een verhoogde ademhaling, zoals tijdens inspanning, leidt tot de verwijdering van CO2, waardoor de vorming van koolzuur wordt verminderd en de pH naar alkaliteit verschuift. Omgekeerd kan een verminderde ademhaling, zoals tijdens hypoventilatie, CO2-ophoping veroorzaken, wat leidt tot verhoogde koolzuurvorming en een verschuiving naar de zuurgraad.
- Renale regulatie: De nieren spelen een cruciale rol bij het handhaven van het evenwicht tussen waterstofionen (H+) en bicarbonaationen (HCO3-) in het bloed. De proximale tubuli in de nieren kunnen H+ afscheiden en HCO3- reabsorberen, waardoor hun concentraties worden gereguleerd en wordt bijgedragen aan de pH-homeostase.
Klinische betekenis:
Verstoringen van het koolzuur-bicarbonaatbuffersysteem kunnen tot verschillende zuur-base-stoornissen leiden. Respiratoire acidose treedt bijvoorbeeld op als er sprake is van overmatige CO2-retentie als gevolg van ademhalingsproblemen, waardoor een toename van koolzuur en een verlaging van de pH ontstaat. Omgekeerd treedt respiratoire alkalose op als er sprake is van overmatig CO2-verlies als gevolg van hyperventilatie, wat leidt tot een afname van koolzuur en een stijging van de pH.
Het begrijpen van het koolzuur-bicarbonaatbuffersysteem is essentieel voor het begrijpen van het zuur-base-evenwicht en de implicaties ervan in verschillende fysiologische en pathologische omstandigheden.
 Raad voor Chemische Veiligheid staat onzekere toekomst te wachten
Raad voor Chemische Veiligheid staat onzekere toekomst te wachten Experiment laat zien hoe met water gevulde kanalen die kriskras door multikristallijn ijs lopen, tot breuken leiden
Experiment laat zien hoe met water gevulde kanalen die kriskras door multikristallijn ijs lopen, tot breuken leiden  Video:Hoe traangas je lichaam beïnvloedt
Video:Hoe traangas je lichaam beïnvloedt  Laserbehandeling toont potentieel voor vermindering van industriële chemische verwerking van voertuigen
Laserbehandeling toont potentieel voor vermindering van industriële chemische verwerking van voertuigen Welk type binding zal HO vormen?
Welk type binding zal HO vormen?
 Wat kwartels ons kunnen leren over de gang van dinosaurussen
Wat kwartels ons kunnen leren over de gang van dinosaurussen  Een kraan bouwen voor een schoolproject
Een kraan bouwen voor een schoolproject Olievoorraden moeten ondergronds blijven om aan de verplichtingen van het Akkoord van Parijs te voldoen, zo blijkt uit onderzoek
Olievoorraden moeten ondergronds blijven om aan de verplichtingen van het Akkoord van Parijs te voldoen, zo blijkt uit onderzoek  Maïsgordellandbouw heeft een derde van zijn koolstofrijke bodem verloren
Maïsgordellandbouw heeft een derde van zijn koolstofrijke bodem verloren Wetenschappers ontdekken wat het hemelfenomeen STEVE . aandrijft
Wetenschappers ontdekken wat het hemelfenomeen STEVE . aandrijft
Hoofdlijnen
- Meisjes zullen jongens zijn:geslachtsverandering bij drakenhagedissen
- Wat zou er gebeuren als een cel geen ribosomen had?
Cellen zijn de kleinste functionele eenheden van alle levende wezens. In de cellen bevinden zich gespecialiseerde structuren, organellen genaamd, die ze helpen bepaalde functies uit te voeren. Rib
- Kan AI-aangedreven objectherkenningstechnologie de tarweziekte helpen oplossen?
- Het magische medicijn van Bezoars
- Voor het eerst vogelgriep gedetecteerd bij alpaca's in de VS
- Nieuw onderzoek vraagt zich af waarom sommige automobilisten agressiever zijn tegenover fietsers
- Gistonderzoek biedt een mogelijk antwoord op de vraag waarom sommige soorten generalisten zijn en andere specialisten
- Betekent Alphabet succes voor Google?
- Onderzoek verklaart waarom bepaalde immuuntherapieën niet altijd werken zoals voorspeld
- Leveren van duurzaam geproduceerde bouwstenen van biomateriaal uit plantaardige grondstoffen

- Vulkaanvormige trend maakt rationeel ontwerp van polysulfidekatalysatoren in lithium-zwavelbatterijen mogelijk
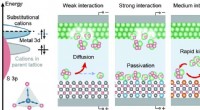
- Nieuwe biochemische verbinding kan milieuverontreinigende stoffen afbreken

- Universeel regulatiemechanisme in plantencellen ontdekt
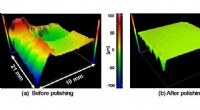
- Eenkristallen diamant klaar maken voor elektronica
 Zin om grapjes te maken over de opwarming van de aarde tijdens een sneeuwstorm? Dit is wat experts dat zeggen
Zin om grapjes te maken over de opwarming van de aarde tijdens een sneeuwstorm? Dit is wat experts dat zeggen  Wat is ruimte? De 300 jaar oude filosofische strijd die vandaag de dag nog steeds woedt
Wat is ruimte? De 300 jaar oude filosofische strijd die vandaag de dag nog steeds woedt De joystick weggooien? Zwitsers ontwikkelen jack dat drones bestuurt
De joystick weggooien? Zwitsers ontwikkelen jack dat drones bestuurt Fysieke kenmerken van aluminiumoxide
Fysieke kenmerken van aluminiumoxide Met behulp van technieken uit de astrofysica, onderzoekers kunnen droogte tot tien weken vooruit voorspellen
Met behulp van technieken uit de astrofysica, onderzoekers kunnen droogte tot tien weken vooruit voorspellen G20:Compromis over klimaatverandering, maar tegen welke prijs?
G20:Compromis over klimaatverandering, maar tegen welke prijs?  Een radicale oplossing komt van het mengen van gereedschappen
Een radicale oplossing komt van het mengen van gereedschappen Hoe zal de klimaatverandering het elektriciteitsnet onder druk zetten? Tip:Kijk naar de dauwpunttemperaturen
Hoe zal de klimaatverandering het elektriciteitsnet onder druk zetten? Tip:Kijk naar de dauwpunttemperaturen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

