
Wetenschap
Wat is pH-waarde?
Zo begrijpt u de pH-waarde:
1. Schaal:De pH-schaal varieert van 0 tot 14.
2. Neutraal punt:Een pH-waarde van 7 wordt als neutraal beschouwd. Een oplossing met een pH van 7 heeft gelijke concentraties waterstofionen (H+) en hydroxide-ionen (OH-).
3. Zuurgraad:Oplossingen met een pH-waarde lager dan 7 worden als zuur beschouwd. Dit betekent dat de concentratie waterstofionen (H+) hoger is dan de concentratie hydroxide-ionen (OH-). Hoe lager de pH-waarde, hoe hoger de zuurgraad.
4. Basiciteit (Alkaliteit):Oplossingen met een pH-waarde boven de 7 worden als basisch of alkalisch beschouwd. In basische oplossingen is de concentratie hydroxide-ionen (OH-) hoger dan de concentratie waterstofionen (H+). Hoe hoger de pH-waarde, hoe hoger de basiciteit.
Het is vermeldenswaard dat de pH-waarde een logaritmische schaal is, wat betekent dat elk geheel getalverschil in de pH-waarde een tienvoudig verschil in de waterstofionenconcentratie vertegenwoordigt. Een oplossing met een pH van 6 heeft bijvoorbeeld tien keer meer waterstofionen dan een oplossing met een pH van 7, terwijl een oplossing met een pH van 8 tien keer minder waterstofionen heeft dan een oplossing met een pH van 7.
Het begrijpen van de pH is belangrijk op verschillende gebieden, waaronder scheikunde, biologie, milieuwetenschappen en zelfs het dagelijks leven, zoals het meten van de zuurgraad van de bodem in de landbouw of het bepalen van de optimale pH voor aquariums en zwembaden.
 Verbeterde stabiliteit in de aanwezigheid van water kan de uitstoot van broeikasgassen in de schoorsteen helpen verminderen
Verbeterde stabiliteit in de aanwezigheid van water kan de uitstoot van broeikasgassen in de schoorsteen helpen verminderen Waarom wordt germanium niet gebruikt als LED-materiaal?
Waarom wordt germanium niet gebruikt als LED-materiaal?  Is het verdampen van alcohol een chemische verandering?
Is het verdampen van alcohol een chemische verandering?  Hoe metalliseert waterstof?
Hoe metalliseert waterstof?  Hoeveel weegt 5,0 mol lithium in gram?
Hoeveel weegt 5,0 mol lithium in gram?
Hoofdlijnen
- Wat is dat fossiel? Een app heeft antwoorden
- Kunnen mensen nog ouder worden? We hebben het maximale nog niet bereikt, zeggen sommige wetenschappers
- Mening:Australië bevindt zich in een unieke positie om de bijendodende Varroamijt uit te roeien. Dit is wat er gebeurt als we dat niet doen
- Enzymonderzoek onthult waarom sommige kankermedicijnen ernstige bijwerkingen veroorzaken
- Hoeveel chromosomen zitten er in een menselijke spiercel?
- Hoe onze mobiele antennes worden gevormd
- Wat is een andere naam voor somatische stamcellen en wat doen ze?
- Nieuw inzicht in hoe planten cellulose maken
- Wat is de eerste stap in het decoderen van genetische berichten?
- Geurafgevende stof kan zweterige gymkleding helpen neutraliseren
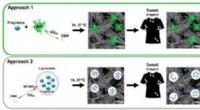
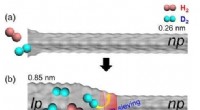
- Nieuwe strategie voor isotopenscheiding met flexibel poreus materiaal
- Eiwitanalyse maakt nauwkeurige targeting van medicijnen mogelijk

- De donkere materie van de moleculaire wereld identificeren

- Meer edele metalen recyclen uit nucleair en elektronisch afval met behulp van het Picasso-pigment, Pruisisch blauw

 Surveillancehulpmiddelen voor antibioticaresistentie in Puerto Ricaanse stroomgebieden na orkaan Maria
Surveillancehulpmiddelen voor antibioticaresistentie in Puerto Ricaanse stroomgebieden na orkaan Maria Een leraar, een spion, een schild - dit nanodeeltje draagt veel hoeden in het lichaam
Een leraar, een spion, een schild - dit nanodeeltje draagt veel hoeden in het lichaam Freshwater Biome Abiotische factoren
Freshwater Biome Abiotische factoren  Nanobuisjes en energie:hype of hoop?
Nanobuisjes en energie:hype of hoop?  Pop-art en strips - imitatie, confrontatie, samenwerking
Pop-art en strips - imitatie, confrontatie, samenwerking Canada kan zich beter voorbereiden op het omscholen van werknemers die ontheemd zijn door disruptieve technologieën
Canada kan zich beter voorbereiden op het omscholen van werknemers die ontheemd zijn door disruptieve technologieën Aerosoldeeltjes koelen het klimaat minder af dan we dachten
Aerosoldeeltjes koelen het klimaat minder af dan we dachten Onzichtbaarheid bereiken:onzichtbaarheid over meerdere golflengten geïntegreerd met onzichtbaarheidstactieken
Onzichtbaarheid bereiken:onzichtbaarheid over meerdere golflengten geïntegreerd met onzichtbaarheidstactieken
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

