
Wetenschap
Experimenten met bifluoride-ionen tonen bewijs van hybride bindingen
Bifluoride-ionen (HF2-) zijn een fascinerend voorbeeld van een polyatomair ion dat hybride bindingen vertoont. Hybride bindingen worden gevormd wanneer atomaire orbitalen met verschillende symmetrieën worden gecombineerd om nieuwe orbitalen te vormen die een meer symmetrische vorm hebben. Dit kan gebeuren wanneer de bij de binding betrokken atomen verschillende elektronegativiteiten hebben, zoals het geval is bij waterstof en fluor.
In het geval van bifluoride-ionen zijn de fluoratomen elektronegatiever dan het waterstofatoom. Dit betekent dat de fluoratomen de elektronen in de binding dichter naar zich toe trekken, waardoor het waterstofatoom een gedeeltelijk positieve lading achterlaat. Deze gedeeltelijke positieve lading op het waterstofatoom trekt de elektronen in de bindingsorbitalen aan, waardoor ze meer geconcentreerd raken tussen de atomen. Deze concentratie van elektronen resulteert in de vorming van hybride bindingen.
De hybride bindingen in bifluoride-ionen zijn sp3-gehybridiseerd. Dit betekent dat de 1s-orbitalen van het waterstofatoom en de drie 2p-orbitalen samen vier gelijkwaardige sp3-hybride orbitalen vormen. Deze hybride orbitalen worden vervolgens gebruikt om bindingen te vormen met de twee fluoratomen.
De sp3-hybridisatie van de bindingen in bifluoride-ionen heeft verschillende belangrijke gevolgen. Ten eerste resulteert het in de vorming van een tetraëdrische moleculaire geometrie. Dit komt doordat de vier sp3-hybride orbitalen in een tetraëdrische vorm zijn gerangschikt. Ten tweede resulteert de sp3-hybridisatie van de obligaties ook in de vorming van sterke bindingen. Dit komt omdat de sp3-hybride orbitalen elkaar efficiënter overlappen dan de zuivere atomaire orbitalen.
Het bewijs voor hybride bindingen in bifluoride-ionen komt uit verschillende bronnen. Eén bewijsstuk is de tetraëdrische moleculaire geometrie van het ion. Deze geometrie is consistent met de sp3-hybridisatie van de bindingen. Een ander bewijsstuk is de sterkte van de bindingen in het ion. De bindingen in bifluoride-ionen zijn sterker dan de bindingen in waterstoffluoride (HF). Dit komt overeen met de sp3-hybridisatie van de bindingen in bifluoride-ionen.
De studie van hybride bindingen in bifluoride-ionen heeft belangrijke inzichten opgeleverd in de aard van chemische bindingen. Dit werk heeft aangetoond dat er hybride bindingen kunnen ontstaan tussen atomen met verschillende elektronegativiteiten, en dat deze bindingen kunnen resulteren in de vorming van moleculen met specifieke geometrieën en eigenschappen.
 Machine learning framework ID's doelen voor het verbeteren van katalysatoren
Machine learning framework ID's doelen voor het verbeteren van katalysatoren Een gel die niet breekt of uitdroogt
Een gel die niet breekt of uitdroogt Voorbeeld van een chemische samenstelling die wordt gebruikt om kunststof te maken
Voorbeeld van een chemische samenstelling die wordt gebruikt om kunststof te maken  Wetenschappers stellen nieuwe methode voor om de winning van moeilijk terug te winnen koolwaterstoffen te vergroten
Wetenschappers stellen nieuwe methode voor om de winning van moeilijk terug te winnen koolwaterstoffen te vergroten Maakt platina deel uit van de platinafamilie?
Maakt platina deel uit van de platinafamilie?
 NASA-satellieten zien afkoeling en krimp in de bovenste atmosfeer als gevolg van klimaatverandering
NASA-satellieten zien afkoeling en krimp in de bovenste atmosfeer als gevolg van klimaatverandering Wat gebeurt er onder je voeten? Virtuele reis binnen de aarde
Wat gebeurt er onder je voeten? Virtuele reis binnen de aarde  Studie:Ringweg om dieselvrachtwagens om te leiden in Sao Paulo verbeterde volksgezondheid
Studie:Ringweg om dieselvrachtwagens om te leiden in Sao Paulo verbeterde volksgezondheid Studie vindt het veranderen van opgeloste organische koolstof in de meren van Maine van cruciaal belang voor het behoud van de drinkwaterkwaliteit
Studie vindt het veranderen van opgeloste organische koolstof in de meren van Maine van cruciaal belang voor het behoud van de drinkwaterkwaliteit Zwarte zomerbranden in Australië hebben de ozonlaag aangetast:studie
Zwarte zomerbranden in Australië hebben de ozonlaag aangetast:studie
Hoofdlijnen
- Hoe vaak komt agressie bij Britse honden voor?
- Verschil in de bloedsomloop van mensen en wormen?
- Wetenschappers tellen keizerspinguïns op Antarctica om factoren te onderzoeken die de bevolking beïnvloeden
- Helpen kunstmatige slaapplaatsen vleermuizen? Experts zeggen dat er meer onderzoek nodig is
- Welke beschrijft het beste de transformatie in bacteriën?
- Geavanceerde beeldvorming werpt licht op immuunontsnapping van vormveranderende schimmel
- Motivaties voor het jagen op dieren in het wild variëren in Afrika en Europa
- Nieuwe bacteriesoort ontdekt in de darm
- Droombetekenissen uitgelegd
- Leuphana-wetenschappers ontwikkelen milieuvriendelijkere antibiotica

- Nieuwe functie voor plantenenzym kan leiden tot groene chemie

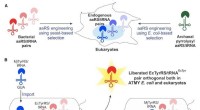
- Gemanipuleerde genetische machinerie afgeleid van E. coli levert nieuwe aminozuren aan eiwitten
- Video:Wat is vlamstralen?

- Een vereenvoudigde methode om olijfolie te categoriseren

 Het verschil tussen Bobcat en Coyote-tracks
Het verschil tussen Bobcat en Coyote-tracks  Elementen van een wetenschapsproject
Elementen van een wetenschapsproject ALMA lokaliseert de vormingsplaats van de planeet rond de dichtstbijzijnde jonge ster
ALMA lokaliseert de vormingsplaats van de planeet rond de dichtstbijzijnde jonge ster Studie onderzoekt erfenissen van brandend regenwoud in British Columbia
Studie onderzoekt erfenissen van brandend regenwoud in British Columbia Studie benadrukt belofte van galliumoxiden voor stralingsdetectoren van de volgende generatie
Studie benadrukt belofte van galliumoxiden voor stralingsdetectoren van de volgende generatie Met AI uitgeruste robots ontwikkelen situationeel bewustzijn in de meest onzekere omgeving van de aarde
Met AI uitgeruste robots ontwikkelen situationeel bewustzijn in de meest onzekere omgeving van de aarde Overdreven radargegevens boven het door het terrein veroorzaakte vriesniveau
Overdreven radargegevens boven het door het terrein veroorzaakte vriesniveau Eerste directe waarneming van het dode-kegeleffect in de deeltjesfysica
Eerste directe waarneming van het dode-kegeleffect in de deeltjesfysica
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

