Wetenschap
Een duidelijker beeld van glaucoom:de relatie tussen ontvouwing en aggregatie voor glaucoom-geassocieerde myociline
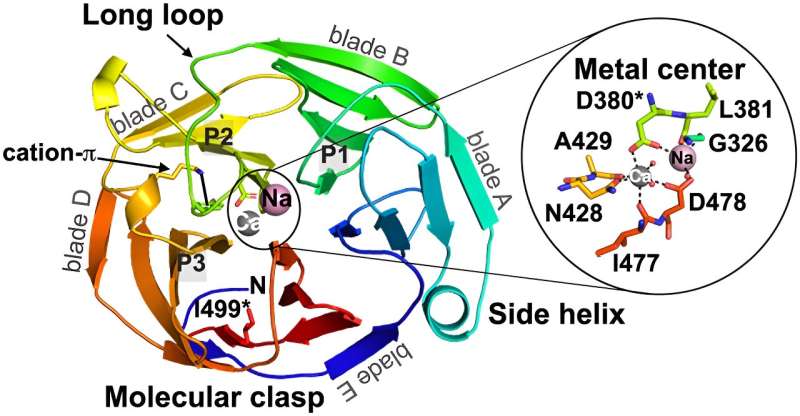
Van Parkinson en Alzheimer tot hartritmestoornissen:amyloïden zijn in verband gebracht met een aantal ziekten. Deze aggregaten van eiwitten vormen zich in het lichaam wanneer een eiwit zijn normale structuur verliest en verkeerd vouwt of muteert. En aangezien veel van deze eiwitten groot en ingewikkeld zijn, blijft de manier waarop sommige van deze mutaties optreden en zich aggregeren een mysterie, net als de ontwikkeling van effectieve behandelingen.
Nieuw onderzoek naar glaucoom onder leiding van scheikundigen van Georgia Tech en een alumna kan daar verandering in brengen.
"Er is veel werk verricht om te begrijpen hoe kleinere gevouwen eiwitten amyloïdeaggregaten vormen, maar deze studie helpt ons de aggregatieroute van een groter, complexer systeem te begrijpen", zegt co-eerste auteur Emily Saccuzzo. Dat werk zou wetenschappers op een dag kunnen helpen nieuwe behandelmethoden te ontdekken, niet alleen voor glaucoom, maar ook voor andere ziekten die worden veroorzaakt door eiwitaggregatie.
Saccuzzo startte het project in 2018 als afgestudeerde student aan het Lieberman Lab van de School of Chemistry and Biochemistry van Georgia Tech, en is nu postdoctoraal onderzoeksmedewerker bij Pacific Northwest National Labs.
"Emily was een zomerstudent voordat ze zich inschreef, en ze stelde de initiële haalbaarheid van het uitvoeren van deze experimenten vast", zegt Raquel Lieberman, professor en Septic Pfeil-leerstoel in de chemie aan Georgia Tech. "Ik ben enorm trots op haar."
De recente bevindingen van hun onderzoeksteam zijn opgenomen in een artikel, "Competition between inside-out ontvouwing en pathogene aggregatie in een amyloid-forming β-propeller", gepubliceerd in het tijdschrift Nature Communications. .
Lieberman en Saccuzzo brachten onderzoekers van binnen en buiten het Instituut samen om aan het onderzoek samen te werken.
"Dit was een zeer multidisciplinair project en dat geeft altijd veel voldoening", zegt Lieberman. "Ik denk dat als je meer mensen aan tafel brengt, je lastige vragen kunt beantwoorden en meer kunt doen dan je alleen kunt doen."
Een ingewikkeld eiwit
Hoewel veel onderzoeken zich hebben gericht op kleinere eiwitten, modeleiwitten genoemd, die 'regels' en bekende patronen voor amyloïdevorming (een gespecialiseerd type eiwitaggregatie) hebben vastgesteld, is het eiwit dat bijdraagt aan glaucoom groter en complexer. Dit type grotere, gecompliceerde eiwitten is relatief onbestudeerd.
"We wisten al een tijdje dat mutaties in myociline ervoor kunnen zorgen dat het eiwit verkeerd vouwt en aggregeert, wat op zijn beurt leidt tot glaucoom", zegt Saccuzzo. “Wat we echter niet wisten, was het exacte mechanisme waardoor dit eiwit verkeerd vouwt en samenklontert.
"Het doel van deze studie was om te bepalen hoe ziektemutanten verkeerd worden gevouwen, in de hoop dat dit ons inzicht zou geven in de eerste stappen in het aggregatietraject", voegt ze eraan toe.
Gelegen op het grensvlak tussen het wit van het oog en de gekleurde iris, vormt het eiwit een kleine ring helemaal rond het oog.
"Elke keer dat je knippert, rek je die spier uit. Elke keer dat de wind heel hard waait, of als je iets in je oog krijgt. Elke keer dat je in je oog wrijft, kun je dit eiwit beïnvloeden, zelfs als het geen ziekte veroorzaakt", zegt Lieberman. zegt.
Toch weten wetenschappers niet zeker wat het eiwit doet. "We weten pas wat het doet als het problemen veroorzaakt", legt ze uit, zoals glaucoom. "We weten niet wat de werkelijke biologische functie ervan is."
Lieberman voelde zich aanvankelijk aangetrokken tot het idee om het eiwit te bestuderen, omdat ze zich afvroeg of het onderzoek naar de modeleiwitten toepasbaar zou kunnen zijn op het eiwit dat glaucoom veroorzaakt.
"De echt vroege onderzoeken toonden aan dat het waarschijnlijk vergelijkbaar was met deze modeleiwitten die amyloïde vormen", zegt Lieberman. "Ik wilde daar onderzoek naar doen, want als we konden aantonen dat dat waar was, zouden we gebruik kunnen maken van de verbazingwekkende middelen en het onderzoek dat is gedaan naar modelsystemen om ons te helpen de ziekte te bestrijden."
Een onvoorspelbaar systeem
"Dit was een van de grootste amyloïdvormende eiwitten die tot nu toe zijn gekarakteriseerd", zegt Saccuzzo, en hoewel het team hoopte dat ze overeenkomsten zouden vinden met modeleiwitten, vertoonde het grotere met glaucoom geassocieerde eiwit een grotere complexiteit.
"Ik denk dat een van de meest verrassende observaties die we hebben gedaan is dat het eiwit zelf ongeveer 90 dagen nadat het is gemaakt niet in evenwicht is", voegt Lieberman toe. "Een van de principes van de eiwitchemie is dat aminozuursequenties een unieke structuur aannemen, en dat alle informatie die nodig is om het eiwit in zijn 3D-structuur te vouwen, in die aminozuursequentie wordt vastgehouden."
Hier schudde het eiwit een kleine hoeveelheid, wat betekent dat het niet in evenwicht was. "Er gebeurt zoveel meer in het systeem dan iemand zich had kunnen voorstellen", legt Lieberman uit. "We gaan ervan uit dat de vorm een aantal eigenschappen bepaalt, maar dit is een ander mysterie van dit eiwit."
Omdat het eiwit zo ingewikkeld is en niet in evenwicht is, "is er een lange lijst met dingen die we niet kunnen voorspellen", zegt Lieberman, eraan toevoegend dat het computervoorspellingen moeilijk maakt, evenals bepaalde experimenten. "Dat was een moment waarop we dachten:wauw, hier is een nieuw systeem waar mensen over moeten nadenken. De regels kunnen misschien verfijnd worden om ons te helpen beter te begrijpen wat er aan de hand is."
De toekomst van eiwitmodellering
Hoewel verder onderzoek nodig zal zijn om te bepalen hoe glaucoom het beste kan worden behandeld, biedt het onderzoek een kritische basis voor toekomstige studies. “Wat mij op dit moment niet duidelijk is, is of we één medicijn kunnen vinden voor alle mensen met mutaties, of dat we een specifiek medicijn nodig hebben voor elk type mutatie dat we tegenkomen”, zegt Lieberman. P>
Hoewel het onderzoek niet bewijst dat één behandeling mogelijk niet voor iedereen effectief is, "toont het zeker aan dat dit systeem veel meer inhoudt dan we ooit hadden verwacht."
"Inzicht in hoe ziektemutanten er op moleculair niveau uitzien, zou de weg kunnen vrijmaken voor structureel specifieke glaucoomtherapieën en diagnostische hulpmiddelen", voegt Saccuzzo toe.
Lieberman en Saccuzzo onderstrepen ook dat het werk dat is gedaan om het eiwit dat verantwoordelijk is voor glaucoom te begrijpen, ook kan worden toegepast op andere grote eiwitten.
"Uiteindelijk zijn meer eiwitten geen modeleiwitten dan modeleiwitten", zegt Lieberman.
"Er zijn nog veel meer systemen, en ik vermoed dat er nog veel meer eiwitten zijn die kunnen aggregeren en kunnen bijdragen aan ziekten of veroudering die nog moeten worden onderzocht. Ik denk dat dit onderzoek de waarde aantoont van het introduceren van veel verschillende benaderingen van onderzoek een ingewikkeld systeem om er meer over te leren."
Meer informatie: Emily G. Saccuzzo et al., Concurrentie tussen inside-out ontvouwing en pathogene aggregatie in een amyloïdevormende β-propeller, Nature Communications (2024). DOI:10.1038/s41467-023-44479-2
Journaalinformatie: Natuurcommunicatie
Aangeboden door Georgia Institute of Technology
 Handheld-gadget voor snelle tests van de voedselkwaliteit
Handheld-gadget voor snelle tests van de voedselkwaliteit Wat betekent neutralisatie?
Wat betekent neutralisatie?  Nieuw kathodemateriaal voor hoogwaardige natriumionbatterijen zou kunnen profiteren van grootschalige energieopslag
Nieuw kathodemateriaal voor hoogwaardige natriumionbatterijen zou kunnen profiteren van grootschalige energieopslag Ag3PO4-katalysator vergemakkelijkt de elektro-oxidatie van propyleenoxide
Ag3PO4-katalysator vergemakkelijkt de elektro-oxidatie van propyleenoxide Zwevende druppeltjes stellen wetenschappers in staat om contactloze chemische reacties uit te voeren
Zwevende druppeltjes stellen wetenschappers in staat om contactloze chemische reacties uit te voeren
 De vraag naar water in Colorado zal naar verwachting in 2050 het aanbod overstijgen:hebben de wetgevers genoeg gedaan om de crisis aan te pakken?
De vraag naar water in Colorado zal naar verwachting in 2050 het aanbod overstijgen:hebben de wetgevers genoeg gedaan om de crisis aan te pakken?  Officieel:Wildvuur bij Lake Tahoe grotendeels buiten de steden gehouden
Officieel:Wildvuur bij Lake Tahoe grotendeels buiten de steden gehouden Door de mens gemaakte vezels en plastic gevonden in de diepste levende organismen
Door de mens gemaakte vezels en plastic gevonden in de diepste levende organismen Dodental krachtige aardbeving in Haïti stijgt naar 1 297
Dodental krachtige aardbeving in Haïti stijgt naar 1 297 Eiland Mayotte in de Indische Oceaan op cycloonalarm
Eiland Mayotte in de Indische Oceaan op cycloonalarm
Hoofdlijnen
- Trilaminaire structuur van het celmembraan
- Waar bevinden lipiden zich in het lichaam?
- Waarom zijn er veel verschillende soorten tRNA-moleculen?
- Australië heeft meer dan één roze meer (veel meer!)
- Anti-verouderingsbehandelingen - de wetenschap van het leven langer
- Componenten van Homeostasis
- Waarom zelfs identieke tweelingen verschillende vingerafdrukken hebben
- Kunstmatige intelligentie gebruikt om bossen in Maines beter te monitoren
- Bewaking op afstand helpt bij het vinden van oplossingen voor crapemyrtle bark scale
 Hoe calciumchloride en water te mengen
Hoe calciumchloride en water te mengen Video van vier bobcats in een buitenwijk toont gezonde populatie
Video van vier bobcats in een buitenwijk toont gezonde populatie Door phonon gemedieerde overdracht van kwantumtoestanden en qubit-verstrengeling op afstand
Door phonon gemedieerde overdracht van kwantumtoestanden en qubit-verstrengeling op afstand North plaza in Cahokia stond waarschijnlijk het hele jaar door onder water, zo blijkt uit onderzoek
North plaza in Cahokia stond waarschijnlijk het hele jaar door onder water, zo blijkt uit onderzoek Veel bevolkingen vrezen groot banenverlies door automatisering:enquête
Veel bevolkingen vrezen groot banenverlies door automatisering:enquête Experimentele faciliteit Asdex Upgrade genereert zijn eerste plasma
Experimentele faciliteit Asdex Upgrade genereert zijn eerste plasma Excretory System Science Project Ideas
Excretory System Science Project Ideas  Wat veroorzaakt de Bioluminescent Bay?
Wat veroorzaakt de Bioluminescent Bay?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com