
Wetenschap
Onderzoeker stelt een paradigmaverschuiving voor in de biochemie van enzymen
Hoewel je misschien nog nooit hebt gehoord van de cytochroom P450-superfamilie van enzymen, spelen deze eiwitten diverse en cruciale rollen bij mensen door de metabolische verwerking van medicijnen, pesticiden, vetzuren, in vet oplosbare vitamines en chemische kankerverwekkende stoffen en de biosynthese van essentiële steroïden. inclusief sterolen.
Sterolen zijn een familie van chemische verbindingen die een centrale, ringvormige structuur delen en die van cruciaal belang zijn voor het leven van een groot aantal organismen. De bekendste sterol bij mensen is cholesterol, een belangrijk onderdeel van ons celmembraan en een voortdurend onderwerp in de gedachten van artsen, aangezien verhoogde cholesterolwaarden in het bloed ons risico op hart- en vaatziekten kunnen verhogen.
Het laboratorium van Fred Guengerich, de Tadashi Inagami, Ph.D. Hoogleraar biochemie aan de Vanderbilt Universiteit bestudeert al vijftig jaar cytochromen P450. In een nieuw artikel gepubliceerd in Angewandte Chemie onderzocht het laboratorium van Guengerich het mechanisme dat wordt gebruikt door cytochroom P450 51 – een P450-enzym dat in alle levensfamilies aanwezig is – om een cruciale driestapsreactie in de biosynthese van sterolen te katalyseren:het metabolisme van lanosterol.
"Dit is een uitdagend maar lonend project geweest dat het eerste ondubbelzinnige antwoord biedt op een al lang bestaande en controversiële mechanistische vraag in de eukaryotische sterolbiosynthese", zegt hoofdauteur en afgestudeerd biochemiestudent Kevin McCarty.
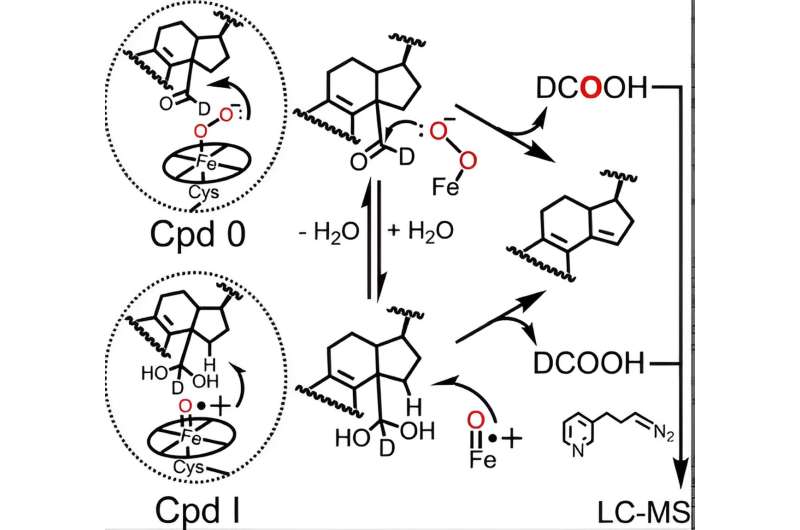
De katalytische cyclus van alle P450-enzymen omvat de vorming van twee actieve heem-ijzersoorten – Verbinding 0 en Verbinding I, waarvan de laatste op natuurlijke wijze wordt gevormd uit Verbinding 0 – die nodig zijn voor door P450 gekatalyseerde reacties, waaronder het metabolisme van lanosterol. Hoewel de rol van Compound I in de eerste twee stappen van het lanosterolmetabolisme goed is vastgesteld, hebben tegenstrijdige gegevens van verschillende laboratoria wetenschappers onduidelijk gemaakt of P450 51 Compound 0 of Compound I gebruikt om de cruciale laatste stap te volbrengen.
Door gebruik te maken van een geavanceerde analytische techniek die aanvankelijk werd verfijnd door voormalig Guengerich-postdoc Francis Yoshimoto, waarmee de opname van een zuurstofisotoop met de naam 18 wordt gevolgd O in de producten van de P450-reactie zijn McCarty en collega's de eersten geworden die suggereren dat zowel Verbinding 0 als Verbinding I een actieve chemische rol kunnen spelen in de laatste stap van het lanosterolmetabolisme.
Resultaten gepresenteerd in de Angewandte Chemie Uit onderzoek blijkt dat hoewel Verbinding 0 de belangrijkste heemsoort is die verantwoordelijk is voor de laatste stap van de katalytische werking van menselijk P450 51 (~85% van de reactie), Verbinding I nog steeds een ondergeschikte, kwantificeerbare rol speelt (~14% van de reactie).
In samenwerking met Galina Lepesheva, onderzoeksprofessor in de biochemie, vergeleken de onderzoekers de relatieve bijdragen van elke heemsoort in vier P450 51-enzymen van pathogene gist, amoeben en trypanosomen, een soort parasiet, aan de menselijke ortholoog. Hoewel de gist- en amoebe-enzymen vergelijkbare resultaten lieten zien als het menselijke eiwit, onthulden de resultaten van de trypanosomale enzymen een interessant mechanistisch verschil:verbinding 0 en verbinding I deelden ongeveer gelijke bijdragen aan de reactie.
Deze resultaten voegen diepte toe aan ons collectieve en mechanistische begrip van P450-enzymen, met name de enzymen die betrokken zijn bij de biosynthese van sterolen.
"Dit was een lang project dat een chemische synthese van 17 stappen vereiste, vijf verschillende gezuiverde P450 51-enzymen van onze medewerker prof. Galina Lepesheva, zeer zorgvuldige aandacht voor het gebruik van een atmosfeer van 18 zuurstof in de reacties, geavanceerde massaspectrometrie met hoge resolutie, en zorgvuldig werk van alle auteurs in ons laboratorium”, aldus Guengerich. Volgens hem zorgde de aandacht voor details van zijn team ervoor dat het 'dit systeem kon kraken' en een duidelijke analyse kon maken van een vertakt enzymmechanisme.
"Onze bevindingen bieden een belangrijke vooruitgang in het begrip van de functie van P450 51 bij mensen en verschillende ziekteverwekkers, waarvan we hopen dat ze nuttig zullen zijn bij de voortdurende zoektocht naar op P450 51 gerichte medicijnen", aldus McCarty.
Momenteel remmen een aantal bestaande antischimmelmedicijnen de P450 51-enzymen van de schimmel, waardoor het vermogen van het organisme om essentiële sterolen te maken en zich voort te planten wordt verstoord. Toch onderstreept de resistentie tegen antischimmelmiddelen, in combinatie met het bestaan van levensbedreigende schimmelinfecties waarvoor geen behandeling bestaat, de voortdurende behoefte aan nieuwe, op P450 51 gerichte geneesmiddelen.
Vooruitkijkend zullen de Guengerich en Lepesheva-laboratoria een P450 51-enzym uit amoebe verder analyseren, op zoek naar mechanistische eigenaardigheden die mogelijk kunnen worden geëxploiteerd als potentiële medicijndoelen.
Meer informatie: Kevin D. McCarty et al, Zuurstof-18-labeling onthult een gemengd Fe-O-mechanisme in de laatste stap van cytochroom P450 51 Sterol 14α-demethylering, Angewandte Chemie International Edition (2024). DOI:10.1002/anie.202317711
Aangeboden door Vanderbilt University
 Hoe pH-waarden te meten
Hoe pH-waarden te meten Ontdekking van geheel nieuwe klasse RNA-caps in bacteriën
Ontdekking van geheel nieuwe klasse RNA-caps in bacteriën Geleidende aard in kristalstructuren onthuld bij een vergroting van 10 miljoen keer
Geleidende aard in kristalstructuren onthuld bij een vergroting van 10 miljoen keer Directe omzetting van roestig roestvrijstalen gaas in stabiel, goedkope elektroden voor kalium-ionbatterijen
Directe omzetting van roestig roestvrijstalen gaas in stabiel, goedkope elektroden voor kalium-ionbatterijen Wat zijn de kleinste deeltjes van een element?
Wat zijn de kleinste deeltjes van een element?
 Een 3D-blik op de 2015 El Nino
Een 3D-blik op de 2015 El Nino Nieuw-Zeeland zal grote banken maken, verzekeraars en bedrijven maken hun klimaatrisico bekend. Het is tijd dat andere landen dat ook deden
Nieuw-Zeeland zal grote banken maken, verzekeraars en bedrijven maken hun klimaatrisico bekend. Het is tijd dat andere landen dat ook deden Wat veroorzaakt de Bioluminescent Bay?
Wat veroorzaakt de Bioluminescent Bay?  Gronddoordringende radar onthult potentiële massagraven van de Holocaust in Litouwen
Gronddoordringende radar onthult potentiële massagraven van de Holocaust in Litouwen Nieuw onderzoek haalt nutriënten terug uit proceswater voor zeevruchten
Nieuw onderzoek haalt nutriënten terug uit proceswater voor zeevruchten
Hoofdlijnen
- Wat is een Punnett-vierkant?
- Waarom walvissen geen hersenbeschadiging oplopen als ze zwemmen
- Bacteriën bieden immuniteit tegen gigantische virussen
- Verschillen tussen "Fysiek" en "Fysiologisch"
- Verklaring van celspecialisatie
- Zuid-Amerikaanse brulapen zijn mogelijk meer bedreigd dan eerder werd gedacht
- Onderzoek onthult belangrijke genetische factoren in de eigenschappen van bonenpeulen
- Drie nieuwe soorten grondslangen ontdekt onder kerkhoven en kerken in Ecuador
- Blauw licht is de belangrijkste factor die de fotodegradatie van bladafval beïnvloedt
- Duurzame nylonproductie mogelijk gemaakt door ontdekking van bacteriën

- Rekbare thermo-elektrische generatoren maken

- Apparaat kan ziekte horen door structuren waarin cellen zijn ondergebracht

- Duurzame coating doodt het COVID-virus en andere ziektekiemen in enkele minuten

- Chemische datamining stimuleert zoektocht naar nieuwe organische halfgeleiders

 Zoutzuur Voorzorgsmaatregelen voor de veiligheid
Zoutzuur Voorzorgsmaatregelen voor de veiligheid  Kopenhagen beste, Rome het slechtst voor schoon, veilige wegen:studie
Kopenhagen beste, Rome het slechtst voor schoon, veilige wegen:studie Stralen en winden uit de kernen van sterrenstelsels lijken een gemeenschappelijke oorzaak te hebben
Stralen en winden uit de kernen van sterrenstelsels lijken een gemeenschappelijke oorzaak te hebben Betrouwbaarheid van digitale tags die de duurzaamheid van kleding meten, resulteert in een positieve houding van de consument
Betrouwbaarheid van digitale tags die de duurzaamheid van kleding meten, resulteert in een positieve houding van de consument Wetenschappers onderzoeken mysterieuze donkere materie
Wetenschappers onderzoeken mysterieuze donkere materie Hoe werken AC-motorstarters?
Hoe werken AC-motorstarters?  Nieuwe tools om risico's in gedeelde, augmented-reality-omgevingen
Nieuwe tools om risico's in gedeelde, augmented-reality-omgevingen COVID-19 benadrukt het belang van wendbaarheid voor toeleveringsketens
COVID-19 benadrukt het belang van wendbaarheid voor toeleveringsketens
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

