
Wetenschap
Nieuw chemisch hulpmiddel voor het begrijpen van membraanremodellering in de cel
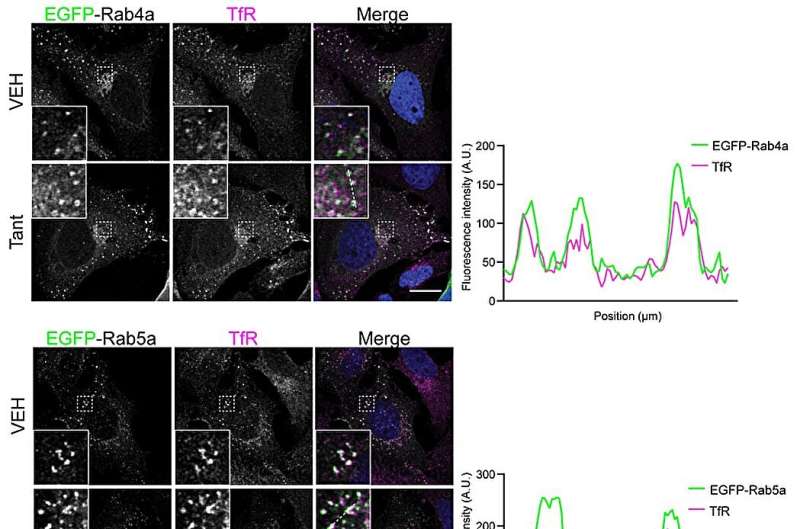
In een studie gepubliceerd in Proceedings of the National Academy of Sciences , beschrijven onderzoekers van Umeå een natuurlijk productachtig molecuul, Tantalosin, dat de interactie tussen twee eiwitten remt in complexen die de membranen in de cel opnieuw vormgeven.