Wetenschap
Onderzoek naar betere biotransformaties

Maagdenpalm van Madagaskar. Krediet:Wikimedia Commons, CC BY-SA
Onderzoek in het International Journal of Bioinformatics Research and Applications heeft de chemie en het gedrag onderzocht van een bruikbaar natuurproduct gemaakt door de maagdenpalm uit Madagaskar (Catharanthus roseus Bunge). Het werk zou het repertoire kunnen uitbreiden van een groeiend gebied van de chemische wetenschap - biotransformatie - waarin de moleculaire machinerie van de natuur wordt gebruikt om nieuwe verbindingen in het laboratorium te bouwen en te veranderen.
Veel natuurlijke producten, per definitie chemische verbindingen gemaakt door levende organismen, hebben fysiologische activiteit en zijn geïsoleerd van hun bron en onderzocht en ontwikkeld tot farmaceutische producten. Inderdaad, ongeveer twee op de vijf geneesmiddelen op recept hebben een oorsprong in natuurlijke producten. Gewoonlijk wordt de actieve chemische stof in een levend organisme echter aangepast voor een bepaald doel of geneesmiddelprofiel met andere, meer gerichte activiteit bij een ziekte en bijvoorbeeld minder of minder schadelijke bijwerkingen. Bovendien is het aanpassen van een natuurlijk product vaak een voorwaarde om een nieuw geneesmiddel voldoende verschillend te maken, zodat een succesvolle octrooiaanvraag kan worden ingediend en een geneesmiddel winstgevend op de markt kan worden gebracht.
In de afgelopen decennia hebben scheikundigen manieren gevonden om enzymen te gebruiken om natuurlijke producten te modificeren en op hun beurt hebben ze manieren gevonden om enzymen te modificeren om ze anders te laten werken en ze in staat te stellen natuurlijke producten en andere moleculen op verschillende manieren te verwerken om ongekende moleculaire diversiteit. Elk van deze enorme aantallen nieuwe moleculen kan fysiologische activiteit hebben die nuttig kan zijn bij de behandeling van bepaalde ziekten en aandoeningen.
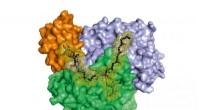
Piotr Szymczyk, Grażyna Szymańska, Małgorzata Majewska, Izabela Weremczuk-Jeżyna, Michał Kołodziejczyk, Kamila Czarnecka, Paweł Szymański en Ewa Kochan van de Medische Universiteit van Łódź, in Łódź, Polen, hebben een deel van de natuur onderzocht C. roseus strictosidine -D-glucosidase. Enzymen zijn eiwitten die inwerken op kleine moleculen, hun substraten, en dat substraat omzetten in een ander molecuul dat door het levende organisme wordt gebruikt. Het team rapporteert de structuur van dit enzym uit de maagdenpalm met een focus op de pocket in zijn moleculaire structuur die bindt aan het substraat, de actieve plaats van het enzym.
Het team bouwde een computermodel van het maagdenpalm-enzym met behulp van Discovery Studio 4.1-software en een sjabloon voor het enzym op basis van een ander bekend enzym van een β-glucosidase dat in rijst wordt gevonden, dat ze hebben aangepast om overeen te komen met de bekende details voor het maagdenpalm-enzym. Ze zouden dan een tweede computerprogramma kunnen gebruiken - een algoritme genaamd CDOCKER - om te zien hoe verschillende chemische substraten zouden interageren met de actieve plaats van het model maagdenpalm-enzym. Ze testten het natuurlijke substraat een molecuul dat bekend staat als strictosidine en een tweede chemische stof D-glucono 1,5-lacton. Van dit laatste molecuul is bekend dat het aan het enzym bindt en de activiteit ervan remt. Het koppelingsproces waarbij substraat in de actieve site wordt geplaatst, zoals een sleutel in een slot, stelde het team vervolgens in staat de structuur van het maagdenpalmenzym te verfijnen om de fijne details van het model dichter bij die in de natuur te brengen. Hiervoor werd moleculaire dynamica-software gebruikt.
Uiteindelijk breidt het werk uit wat eerder bekend was over het maagdenpalm-enzym en zou het wetenschappers in staat kunnen stellen het op zo'n manier aan te passen dat het op andere substraten inwerkt. Maar daarvóór, aangezien het natuurproduct strictosidine zelf een bruikbaar uitgangsmateriaal is voor een groot aantal verschillende moleculen, opent het werk nieuwe wegen om met dit natuurproduct te werken. + Verder verkennen
Onderzoekers onderzoeken enzymen die een kation gebruiken, geen zuurstoftoevoeging, om reacties aan te sturen
 Onderzoek onthult structuur van humane endogene reverse transcriptase
Onderzoek onthult structuur van humane endogene reverse transcriptase Synthetisch rubber presteert beter dan natuurlijk rubber
Synthetisch rubber presteert beter dan natuurlijk rubber Hoe twee isomeren van [IrC₄H₂]⁺ onafhankelijk reageren met methaan of water
Hoe twee isomeren van [IrC₄H₂]⁺ onafhankelijk reageren met methaan of water Twee verschillende fysieke mechanismen geïdentificeerd voor hoe eenvoudig schuim instort
Twee verschillende fysieke mechanismen geïdentificeerd voor hoe eenvoudig schuim instort Voor schonere lucht, water, en aarde
Voor schonere lucht, water, en aarde
 Achtste Grade Science Fair-projecten met make-up
Achtste Grade Science Fair-projecten met make-up Voor een groenere toekomst, we moeten accepteren dat er niets inherent duurzaams is aan digitaal gaan
Voor een groenere toekomst, we moeten accepteren dat er niets inherent duurzaams is aan digitaal gaan Afbeelding:Verlaten Venetiaanse lagune
Afbeelding:Verlaten Venetiaanse lagune Taal gebruiken om de wereld van fossiele brandstoffen vreemd en lelijk te maken
Taal gebruiken om de wereld van fossiele brandstoffen vreemd en lelijk te maken NASA volgt tropische depressie Emily over Florida naar de Atlantische Oceaan
NASA volgt tropische depressie Emily over Florida naar de Atlantische Oceaan
Hoofdlijnen
- Zeldzame fossiele tanden vernietigen lang gekoesterde opvattingen over de evolutie van gewervelde dieren
- Kaperparasiet geblokkeerd voor infiltratie van bloed
- Hoe wordt glucose opgeslagen in plantencellen?
- Dieren die menselijke DNA-sequenties delen
- Wat doet de DNA-nucleotide volgorde code voor?
- Wat is het geheim van geluk?
- Bacterieel controlemechanisme voor aanpassing aan veranderende omstandigheden
- Plasticity Cell Definition
- Belangrijke soorten bacteriën
 Nieuw record voor lengte koolstof-koolstof enkelvoudige binding
Nieuw record voor lengte koolstof-koolstof enkelvoudige binding SK Hynix boekt recordwinsten op stijgende vraag
SK Hynix boekt recordwinsten op stijgende vraag Lettere patenti helpt bij het beoordelen van de intensiteit van historische aardbevingen in Midden-Italië
Lettere patenti helpt bij het beoordelen van de intensiteit van historische aardbevingen in Midden-Italië Hoe klikken op een vacaturesite vooroordelen kunnen onthullen
Hoe klikken op een vacaturesite vooroordelen kunnen onthullen Bahama's zetten zich schrap terwijl nieuw gevormde orkaan Isaias neerstort
Bahama's zetten zich schrap terwijl nieuw gevormde orkaan Isaias neerstort maan kaarten, maan oorsprong en alles daartussen
maan kaarten, maan oorsprong en alles daartussen Uit onderzoek blijkt dat er geen wondermiddel is om de regionale neiging om een bedrijf te starten te versterken
Uit onderzoek blijkt dat er geen wondermiddel is om de regionale neiging om een bedrijf te starten te versterken Vrijwilligers vinden 560, 000 jaar oude melktand in Frankrijk
Vrijwilligers vinden 560, 000 jaar oude melktand in Frankrijk
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com