
Wetenschap
De verrassende Zwitserse legermes-achtige functies van een krachtig enzym
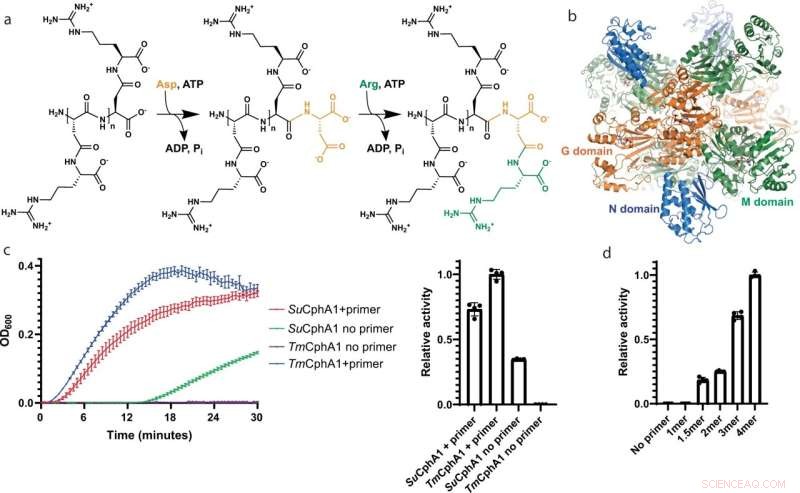
CphA1-structuur en activiteit. een Schematisch diagram van de biosynthetische reacties gekatalyseerd door de G- en M-domeinen van CphA1. b De algemene structuur van tetrameer CphA1 van Synechocystis sp. UTEX2470 (Zo CphA1, VOB-code 7LG5). ATP-moleculen markeren de posities van de actieve plaatsen van het G (oranje) en M (groen) domein. Het N-domein is blauw gekleurd. c Cyanophycine-biosyntheseplots en snelheidsvergelijking van synthese door Su CphA1 en Tm CphA1 met en zonder primer. Tm CphA1 is volledig inactief in afwezigheid van primer. n = 4 onafhankelijke experimenten. Gegevens worden gepresenteerd als individuele metingen en gemiddelde waarde, foutbalken vertegenwoordigen SD-waarden. d Activiteitsniveaus van Tm CphA1 in aanwezigheid van verschillende cyanophycine-primers:1mer (β-Asp-Arg)1 , 1.5meer (β-Asp-Arg)-Asp, 2meer (β-Asp-Arg)2 , 3mer (β-Asp-Arg)3 , 4mer (β-Asp-Arg)4 . n = 4 onafhankelijke experimenten. Gegevens worden gepresenteerd als individuele metingen en gemiddelde waarde, foutbalken vertegenwoordigen SD-waarden. Krediet:Natuurcommunicatie (2022). DOI:10.1038/s41467-022-31542-7
Blauwgroene algen (ook bekend als cyanobacteriën) hebben een superkracht die hen waarschijnlijk helpt om zeer succesvol te zijn als indringers van waterwegen. Ze hebben een buitengewoon vermogen om energie en stikstof in hun cellen op te slaan voor tijden van nood. Maar hoe ze dat precies doen, blijft slechts gedeeltelijk begrepen.
Nu hebben onderzoekers van de McGill University en hun medewerkers aan de ETH Zürich een intrigerend tot nu toe onbekend vermogen ontdekt van de enzymen (bekend als cyanophycinesynthetasen) die actief zijn bij het creëren van deze voedselreserves. Hun bevindingen, beschreven in een recent artikel in Nature Communications , zijn niet alleen wetenschappelijk verrassend, maar brengen ons een stap dichter bij het gebruik van deze milieuvriendelijke polymeren voor alles, van verband tot biologisch afbreekbare antiscalants tot dierlijk voedsel.
Enzymen zoals cyanophycinesynthetasen (polymerase-enzymen genoemd omdat ze lange ketens van polymeren synthetiseren) vereisen meestal primers in de vorm van korte "startketens" om te beginnen met het samenstellen van de lange ketens. Polymerasen fungeren als katalysatoren voor een breed scala aan biologische functies, van het op gang brengen van het proces van RNA- en DNA-replicatie tot het omzetten van glucose in glycogeen als een manier om energie op te slaan voor later gebruik. Van cyanophycinesynthetasen van veel verschillende cyanobacteriën werd gedacht dat ze primers nodig hadden zoals alle andere polymerasen, maar toen ontdekten de onderzoekers iets nieuws.
"We werkten met verschillende cyanophycinesynthetasen en ontdekten dat een van hen geen primer hoefde te krijgen", zegt hoofdauteur Itai Sharon, een McGill Ph.D. student Biochemie. "Na drie jaar experimenten, in een poging om erachter te komen waarom niet, ontdekten we dat deze cyanophycinesynthetase een verborgen reactiecentrum in zich had dat bindingen tussen aminozuren splitst, in plaats van aminozuren te koppelen, wat de belangrijkste taak van deze polymerase is."
In tegenstelling tot alle bekende polymerasen
De onderzoekers ontdekten dat cyanophycinesynthetase langzaam extreem kleine aantallen lange cyanophycine-polymeren kon maken in afwezigheid van primer, die het nieuw ontdekte reactiecentrum in vele korte ketens splitst die vervolgens worden gebruikt als primers voor snelle polymerisatie.
"We noemen cyanophycinesynthetase een 'Zwitsers zakmesenzym', zegt Martin Schmeing, corresponderend auteur en directeur van het McGill Centre de recherche en biologie structurale. , zelfvoorzienende polymerisatiemachine."
"Wat het nog specialer maakt, is dat deze polymerasen al tientallen jaren en decennia door veel onderzoekers zijn bestudeerd. Niemand, ook wij niet, was dit eerder opgevallen." + Verder verkennen
Hoe bacteriën een spaarvarken creëren voor de magere tijden
 Wetenschappers ontdekken een nieuw mechanisme om de sterkte en taaiheid van legeringen met hoge entropie te vergroten
Wetenschappers ontdekken een nieuw mechanisme om de sterkte en taaiheid van legeringen met hoge entropie te vergroten Onderzoekers vinden nieuwe suikervervangers in citrus die de voedings- en drankenindustrie kunnen veranderen
Onderzoekers vinden nieuwe suikervervangers in citrus die de voedings- en drankenindustrie kunnen veranderen Winnende ideeën over wetenschappelijke beurzen waarbij honden betrokken zijn
Winnende ideeën over wetenschappelijke beurzen waarbij honden betrokken zijn Hoe de initiële reactiesnelheid te berekenen
Hoe de initiële reactiesnelheid te berekenen  Welke soorten graniet stralen het meeste radon uit?
Welke soorten graniet stralen het meeste radon uit?
 Een team van klimatologen bestudeert hoe fouten in de waargenomen klimaattrend kunnen worden geminimaliseerd
Een team van klimatologen bestudeert hoe fouten in de waargenomen klimaattrend kunnen worden geminimaliseerd De effecten van riolering op aquatische ecosystemen
De effecten van riolering op aquatische ecosystemen  Opwarming van de aarde kan het dubbele zijn van wat klimaatmodellen voorspellen
Opwarming van de aarde kan het dubbele zijn van wat klimaatmodellen voorspellen 5 dingen die je niet wist over de winterzonnewende
5 dingen die je niet wist over de winterzonnewende  Ongebruikelijke gletsjerstroom zou de allereerste blik op ijsstroomvorming kunnen zijn
Ongebruikelijke gletsjerstroom zou de allereerste blik op ijsstroomvorming kunnen zijn
Hoofdlijnen
- Octopussen geven de voorkeur aan bepaalde wapens bij het jagen en passen tactieken aan hun prooi aan
- Saguaro en andere torenhoge cactussen hebben een roerige geschiedenis
- De voordelen van Anaerobe Ademhaling
- Hoe komt glycolyse voor?
- Wat is de relatie tussen een chromosoom en een allel?
- Zeegras is wereldwijd een belangrijk visgebied
- Onderzoek onthult dat controversiële insecticiden giftig zijn voor zangvogels
- Waarom lijden 600 meisjes in Mexico aan collectieve hysterie?
- Zooplankton Vs. fytoplankton
- Nieuwe efficiënte katalysator voor belangrijke stap in kunstmatige fotosynthese

- Structureel bewijs voor een dynamische metallocofactor tijdens distikstofreductie door Mo-nitrogenase
- Nieuw antischimmelmiddel van mierenboerderijen

- Wetenschapper bouwt kunstmatige fotosynthetische cellen
- Koud gaan:de toekomst van elektronenmicroscopie

 Ingrediënten voor leven onthuld in meteorieten die op aarde vielen
Ingrediënten voor leven onthuld in meteorieten die op aarde vielen Zelfaangedreven draadloze sensoren ingebed in wegen kunnen kuilen en andere gevaren opsporen
Zelfaangedreven draadloze sensoren ingebed in wegen kunnen kuilen en andere gevaren opsporen Menselijke impact op het ecosysteem van Nieuw-Zeeland
Menselijke impact op het ecosysteem van Nieuw-Zeeland  Tunnelvisie voor bestelwagens kan vervuiling verminderen
Tunnelvisie voor bestelwagens kan vervuiling verminderen Als het gezicht past:Tokyo 2020 om gezichtsherkenning in te zetten
Als het gezicht past:Tokyo 2020 om gezichtsherkenning in te zetten Nieuwe planningstool biedt zowel betere vluchtkeuzes als hogere winsten van luchtvaartmaatschappijen
Nieuwe planningstool biedt zowel betere vluchtkeuzes als hogere winsten van luchtvaartmaatschappijen Een habitat maken voor een schoolproject
Een habitat maken voor een schoolproject Het kapitalisme doodt de populaties wilde dieren in de wereld, niet de mensheid
Het kapitalisme doodt de populaties wilde dieren in de wereld, niet de mensheid
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

