Wetenschap
Onderzoekers onderzoeken structurele veranderingen in snel ingevroren eiwitten
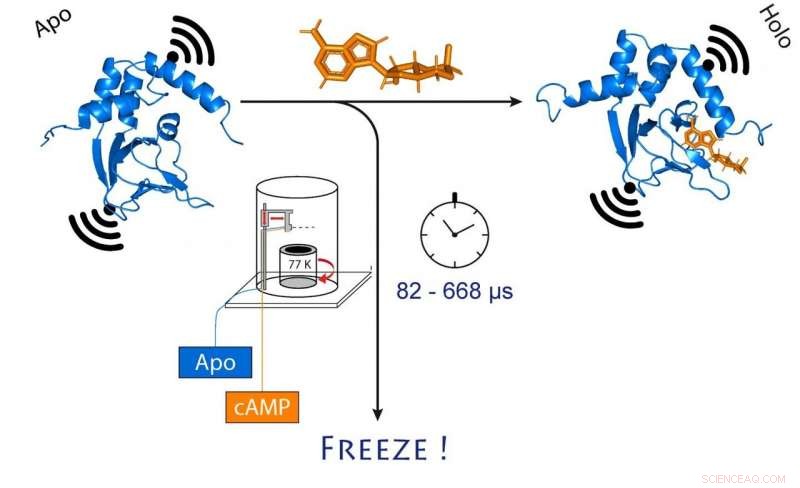
wanneer cAMP (oranje) bindt. Dit verandert ook de afstand tussen de twee moleculaire magneten die aan het kanaal zijn bevestigd (zwart). Krediet:(c) Tobias Hett / Universität Bonn und Forschungszentrum caesar
Onderzoekers van de Universiteit van Bonn en het onderzoekscentrum caesar zijn erin geslaagd om eiwitten na een welbepaalde tijd ultrasnel in te vriezen. Ze waren in staat om structurele veranderingen op de microseconde tijdschaal en met sub-nanometer precisie te volgen. Vanwege de hoge ruimtelijke en temporele resolutie, de methode maakt het mogelijk om snelle structurele veranderingen in enzymen en nucleïnezuren te volgen. De resultaten worden gepubliceerd in de Tijdschrift van de American Chemical Society.
Als je wilt weten hoe de ruimtelijke structuur van een biomolecuul eruitziet, je hebt een formidabel arsenaal aan tools tot je beschikking. De meest populaire zijn elektronenmicroscopie en röntgendiffractie, die zelfs de kleinste details van een eiwit kan onthullen. Echter, een belangrijke beperking van die methoden is dat ze meestal statische afbeeldingen opleveren, die vaak onvoldoende zijn om biomoleculaire processen in precieze mechanistische termen te begrijpen. Daarom, een langetermijndoel van veel onderzoeksgroepen over de hele wereld was om de bewegingen binnen een macromolecuul zoals een eiwit in de loop van de tijd te volgen terwijl het zijn werk uitvoert, net als in een film. De onderzoeksgroepen onder leiding van Prof. Dr. Olav Schiemann van het Instituut voor Fysische en Theoretische Chemie van de Universiteit van Bonn en Prof. Dr. Benjamin Kaupp van het Onderzoekscentrum Caesar van de Max Planck Society zijn nu een stap dichter bij het bereiken van dit doel.
Ze kozen een ionenkanaal voor hun onderzoek. Dit is een eiwit dat minuscule poriën in het celmembraan vormt die doorlaatbaar zijn voor geladen deeltjes die ionen worden genoemd. "Dit kanaal is normaal gesproken gesloten, " legt Schiemann uit. "Het gaat pas open als een cellulaire boodschapper, genaamd cAMP, eraan bindt. We wilden weten hoe dit proces precies werkt."
Minimagneten om afstanden te meten
Om dit te doen, de onderzoekers mengden eerst het kanaaleiwit en cAMP en vroren de oplossing vervolgens snel in. In bevroren toestand, de eiwitstructuur kan nu worden geanalyseerd. Om hun methode te laten werken, ze hadden moleculaire elektromagneten op twee punten in het kanaal bevestigd. De afstand tussen deze magneten kan worden bepaald met een precisie van enkele Angstrom (tien miljardsten van een millimeter) met behulp van een geavanceerde methode genaamd PELDOR, die werkt als een moleculaire liniaal. In recente jaren, de methode werd significant verfijnd en verbeterd in de groep van Schiemann.
"Echter, dit geeft ons alleen een statisch beeld van cAMP-binding aan het ionkanaal, Schiemann zegt. "Daarom hebben we het invriesproces op verschillende tijdstippen herhaald na het mengen van de twee moleculen. Hierdoor konden de bewegingen in het eiwit na cAMP-binding worden gereconstrueerd - net als in een film, die ook bestaat uit een opeenvolging van beelden."
Centraal in deze procedure staat een geavanceerde methode waarmee monsters zeer snel en op een precies tijdstip kunnen worden gemengd en ingevroren. De techniek, genaamd "microseconde freeze hyperquenching" (afgekort MHQ), is oorspronkelijk ontwikkeld aan de TU Delft, maar raakte later in onbruik. Het werd herontdekt en beslist verfijnd door de groep van Kaupp.
"In het MHQ-apparaat, het cAMP-molecuul en het ionkanaal worden ultrasnel gemengd, " legt Kaupp uit. "Vervolgens wordt het mengsel bij -190 °C als een haardun stroompje op een zeer koude metalen cilinder geschoten, die draait 7, 000 keer per minuut. Het was bijzonder uitdagend om de bevroren monsters voor de PELDOR-meting van de metalen plaat over te brengen in dunne glazen buizen, en om ze ondertussen bevroren te houden. Daar moesten we speciaal gereedschap voor ontwerpen en bouwen."
Diepvriezen in 82 miljoenste van een seconde
Het hele meng- en invriesproces duurt slechts 82 microseconden (één microseconde is gelijk aan een miljoenste van een seconde). "Hierdoor kunnen we zeer snelle veranderingen in de ruimtelijke structuur van eiwitten visualiseren, " legt Tobias Hett uit, een van de twee promovendi die een belangrijke bijdrage hebben geleverd aan het succes. Het voordeel van de methode is de combinatie van een hoge ruimtelijke en temporele resolutie. "Dit is een grote stap voorwaarts in het bestuderen van dynamische processen in biomoleculen, ’ benadrukt Kaupp.
De onderzoekers zijn van plan om met hun methode nu ook andere biomoleculen onder de loep te nemen. Ze hopen op nieuwe inzichten, bijvoorbeeld in de werking van enzymen en nucleïnezuren. Het belang van dergelijke inzichten wordt het best geïllustreerd door de recente wereldwijde golf van structureel onderzoek naar het SARS-coronavirus-2:het zogenaamde spike-eiwit van het virus ondergaat ook een structurele verandering wanneer menselijke cellen worden geïnfecteerd. Het verduidelijken van dit mechanisme zal waardevolle informatie opleveren over hoe het infectiemechanisme met nieuwe medicijnen kan worden aangepakt.
De voorbereiding van de monsters, de experimentele uitvoering, en de analyse van de gegevens is zeer complex. De resultaten van de studie weerspiegelen daarom ook een succesvolle wetenschappelijke samenwerking met onderzoekers onder leiding van Prof. Dr. Helmut Grubmüller van het Max Planck Instituut voor Biofysische Chemie in Göttingen en Prof. Dr. Heinz-Jürgen Steinhoff van de Universiteit van Osnabrück.
 Wetenschappers ontdekken dat watermicrodruppels kunnen veranderen in waterstofperoxide wanneer ze condenseren op koude oppervlakken
Wetenschappers ontdekken dat watermicrodruppels kunnen veranderen in waterstofperoxide wanneer ze condenseren op koude oppervlakken Nieuw onderzoek optimaliseert zowel elasticiteit als stijfheid in hetzelfde materiaal zonder de gebruikelijke compromissen
Nieuw onderzoek optimaliseert zowel elasticiteit als stijfheid in hetzelfde materiaal zonder de gebruikelijke compromissen Grote stap voorwaarts in de productie van groene waterstof
Grote stap voorwaarts in de productie van groene waterstof De effecten van zoutconcentratie op bacteriegroei
De effecten van zoutconcentratie op bacteriegroei Nieuw isolatiemateriaal zorgt voor een efficiëntere elektriciteitsdistributie
Nieuw isolatiemateriaal zorgt voor een efficiëntere elektriciteitsdistributie
 Het aantal klimaatontkenners in Australië is meer dan het dubbele van het wereldwijde gemiddelde, nieuwe enquête vondsten
Het aantal klimaatontkenners in Australië is meer dan het dubbele van het wereldwijde gemiddelde, nieuwe enquête vondsten Branden pieken in Amazone Brazilië, wetenschappers zeggen:
Branden pieken in Amazone Brazilië, wetenschappers zeggen: Weerspiegelt GTA5 de opmars van klimaatverandering en plasticvervuiling?
Weerspiegelt GTA5 de opmars van klimaatverandering en plasticvervuiling? Onderzoekers werken aan verbetering van herstel uit krappe schaliereservoirs
Onderzoekers werken aan verbetering van herstel uit krappe schaliereservoirs Arctisch zee-ijs wordt sneller dunner dan verwacht
Arctisch zee-ijs wordt sneller dunner dan verwacht
Hoofdlijnen
- Wat gebeurt er in de interfase van de celcyclus?
- Wat is een regeling in de microbiologie?
- Kwallen hebben superkrachten - en andere redenen waarom ze hun slechte reputatie niet verdienen
- Studie belicht de instandhoudingsbehoeften van recent ontdekte vissoorten in Southwest Virginia
- Een bijtend rapport:onderzoek toont aan dat klimaatverandering een grote bedreiging vormt voor hommels
- 25 soorten onthuld voor 25 Genomes Project
- Chemische reacties vereist voor het onderhoud van Homeostasis
- Celsignalen die wondgenezing in gang zetten zijn verrassend complex
- Woestijnmieren kunnen de betrouwbaarheid van oriëntatiepunten beoordelen terwijl ze op zoek zijn naar de weg naar huis
 Europa zoekt gehandicapte astronauten, meer vrouwen in de ruimte
Europa zoekt gehandicapte astronauten, meer vrouwen in de ruimte Hoe Kva tot Amp
Hoe Kva tot Amp Hoe een PCR-primer te ontwerpen
Hoe een PCR-primer te ontwerpen  De oceaan voorspellen:verbeterde voorspellingen en inzichten voor de Middellandse Zee en de Zwarte Zee
De oceaan voorspellen:verbeterde voorspellingen en inzichten voor de Middellandse Zee en de Zwarte Zee Tip-verbeterde Raman-verstrooiing kan onderscheid maken tussen twee structureel vergelijkbare aangrenzende moleculen
Tip-verbeterde Raman-verstrooiing kan onderscheid maken tussen twee structureel vergelijkbare aangrenzende moleculen Hoe nomadenplaneten werken
Hoe nomadenplaneten werken  Wetenschappers pleiten voor herstel van de planeetstatus van Plutos
Wetenschappers pleiten voor herstel van de planeetstatus van Plutos Lijst met dingen Dr. George Carver uitgevonden met pinda's
Lijst met dingen Dr. George Carver uitgevonden met pinda's
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com